提高营养吸收-脂质体简介
脂质体已经广泛应用在药物和营养应用中。通过长循环停留时间的能力,脂质体可增强对靶向组织的药物递送。
来源:本网编辑 2023.06.11.
脂质体已经广泛应用在药物和营养应用中。通过长循环停留时间的能力,脂质体可增强对靶向组织的药物递送。与游离成分相比,脂质体药物表现出降低的毒性并保持增强的疗效。然而,尚需要更多时间来证明这些声称是成功的。基于药物应用和现有产品,可以说脂质体在现代递送系统中已经确立了其地位。
了解脂质体辅酶Q10泛醌的适应证及产品购买:
了解脂质体维生素C的适应证及产品购买:
概述
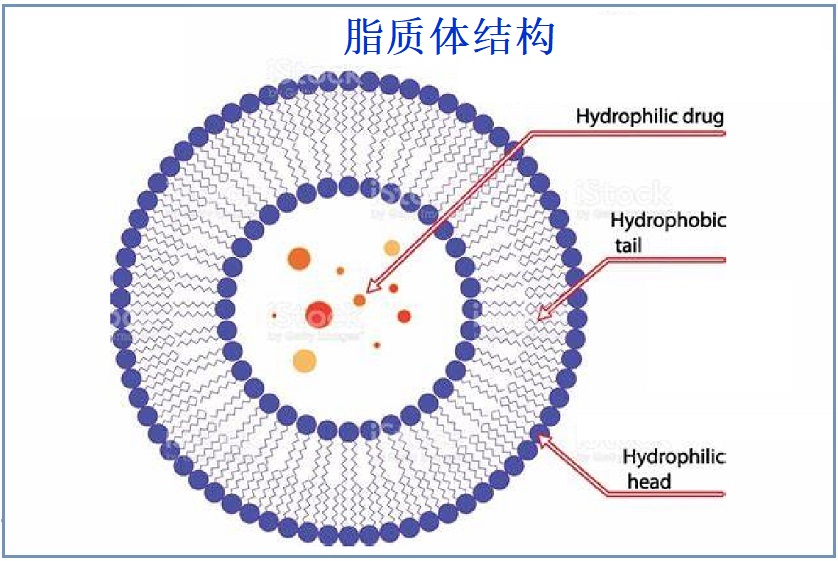
脂质体(Liposome)是一种封闭的球形脂质双层,它形成一个能够携带活性成分的内腔(空心)。脂质双层由两片紧密排列的磷脂组成。这些分子具有疏水的尾部和亲水的头部区域。当两个单一的膜结合在一起时,疏水性的尾部相互吸引,而两个膜的头部都被周围的水吸引。这形成了双层磷脂分子,将空腔内物质与外部环境隔开。然后,与脂质体一起运输到需要的地方。脂质体于1965年由英国学者Alec Bangham和Standish首次发现和描述。随之,脂质体产品逐渐进入了市场。今天,脂质体制剂是各种科学学科中非常有用的复制品、试剂和工具,包括数学和理论物理、生物物理学、化学、胶体科学、生物化学和生物学。在几种有前途的新药递送系统中,脂质体是一种将活性分子递送到作用位点的先进技术,目前有几种制剂正在临床使用。
脂质体技术的研究已经从传统的囊泡发展到“第二代脂质体”,其中通过调节囊泡的脂质组成、大小和电荷来获得长循环脂质体。还使用几种分子,如糖脂或唾液酸,开发了具有修饰表面的脂质体。
脂质体组成和分类:
1.脂质体的组成:类脂质(磷脂)及附加剂。- 磷脂类:包括天然磷脂和合成磷脂二类。磷脂的结构特点为一个磷酸基和一个季铵盐基组成的亲水性基团,以及由两个较长的烃基组成的亲脂性基团。
- 胆固醇:胆固醇与磷脂是共同构成细胞膜和脂质体的基础物质。胆固醇具有调节膜流动性的作用,故被称为脂质体“流动性缓冲剂”。
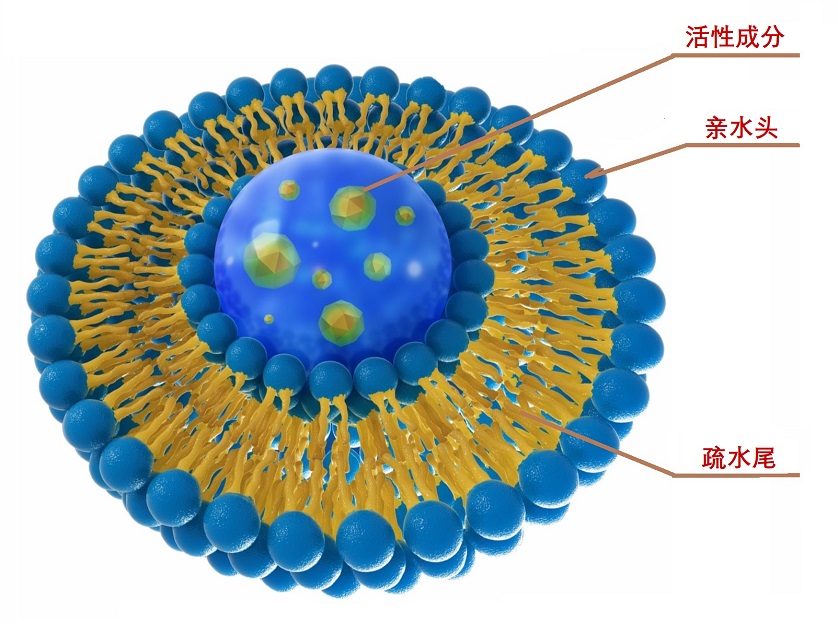
图1,脂质体构造(图源:互联网)
2.脂质体分类:
脂质体的大小可以从非常小(0.025μm)到大(2.5μm)的囊泡不等。此外,脂质体可以具有单层或双层膜。囊泡大小是决定脂质体循环半衰期的一个重要参数,双层的大小和数量都会影响脂质体中药物包封的量。
根据双层的大小和数量,脂质体也可分为两类:
- 多层囊泡(MLV)
- 单层囊泡。单室囊泡又可分为两类:大单室小泡(LUV)和小单室小囊泡(SUV)。小单室脂质体(SUV):粒径约0.02~0.08μm;大单室脂质体 (LUV)为单层大泡囊,粒径在0.1~lμm。
此外,按照电荷可分为:中性脂质体,负电荷脂质体,正电荷脂质体等。
脂质体作用过程
脂质体与细胞之间作用的主要形式包括膜间转运(细胞膜的脂质交换)、接触释药、吸附、融合和内吞。脂质体具有类细胞结构,进入体内主要被网状内皮系统吞噬而激活机体自身的免疫功能,并改变包封活性成分的体内分布,使其主要在肝、脾、肺和骨髓等组织器官中积蓄,从而提高治疗指数、减少治疗剂量和降低其毒性。
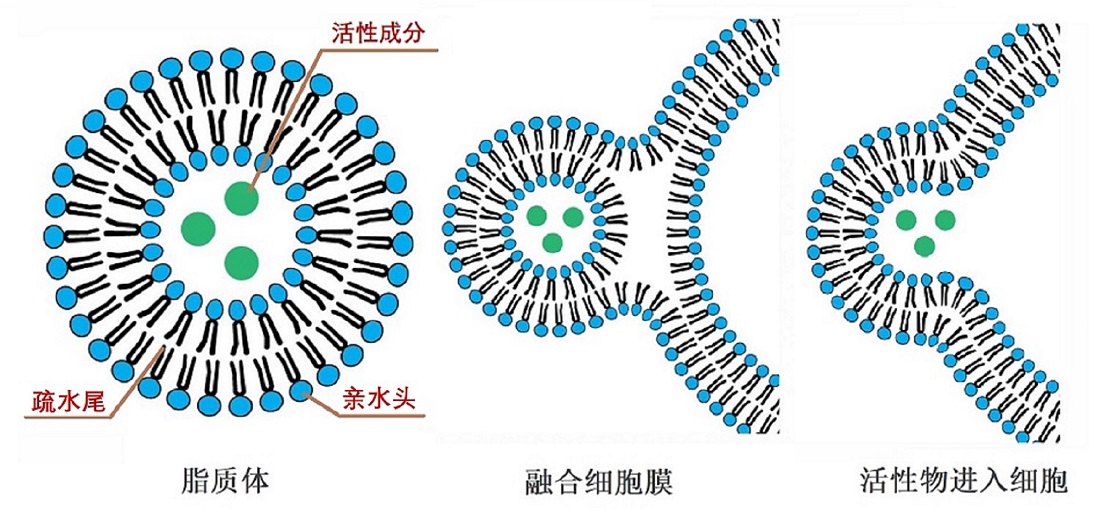
图2,脂质体与细胞融合过程(图源:互联网)
脂质体给药途径主要包括:静脉注射、肌内和皮下注射、口服给药、眼部给药、肺部给药、经皮给药和鼻腔给药等。
Liposome优缺点
1.脂质体主要优点包括如下:- 脂质体提高了活性成分的疗效作用。
- 脂质体通过包封技术改善稳定性。
- 脂质体无毒、柔韧、生物相容、完全可生物降解,对全身和非全身给药无免疫原性。
- 脂质体降低胶囊成分的毒性。
- 脂质体有助于减少敏感组织暴露于有毒药物。
2.脂质体主要缺点包括:
- 在水溶液中,溶解度低。
- 半衰期短。
- 有时磷脂会发生类似氧化和水解反应。
- 胶囊活性成分的泄漏和融合。
- 生产成本高。
Liposome用途
作为高度通用的纳米颗粒,脂质体已被用于许多生物医学应用。脂质体作为胆固醇和天然无毒磷脂基球形囊泡,由于其生物相容性、合适的尺寸以及合适的疏水性和亲水性,为药物递送提供了许多生物医学机会。此外,脂质体制剂对化妆品行业产生了巨大影响,因为它们为药物载体提出了许多独特的特性。另一方面,脂质体在食品和农业中的巨大应用潜力也不容低估。已经进行了许多关于脂质体包封的研究,以开发合适的递送系统来包埋不稳定的化合物。脂质体颗粒中的无脊椎动物成分,如抗菌剂、抗氧化剂、疏水性和亲水性化合物,可用于靶向递送并防止成分和功能破坏。
纳米脂质体因其独特的生物相容性、生物降解性、亲水性和亲脂性载药能力,是开发癌症药物传递系统的良好粒子。基于脂质体的结构拥有世界上最商业化的递送系统。目前正在进行各种关于改善药物毒性和脂质体特异性靶向的研究。
在营养素脂质体开发和应用中,较常见的是维生素C、辅酶Q10,以及维生素B族、矿物质等。
不过,仍没有与辅酶Q10、维生素C等脂质体的吸收和生物利用度的临床测试数据。
主要参考文献:
1. Akbarzadeh A et al. Liposome: classification, preparation, and applications. Nanoscale Res Lett. 2013; 8(1): 102.
2. Nakhaei P et al. Liposomes: Structure, Biomedical Applications, and Stability Parameters With Emphasis on Cholesterol. Front Bioeng Biotechnol. 2021 Sep 9;9:705886.

