新冠后遗症的饮食与营养补充指南
在新冠病毒病(COVID-19)大流行之初,全球努力的重点是遏制病毒的传播和避免传染。目前,很明显,卫生专业人员应该处理COVID-19幸存者的整体健康状况。
来源:本网编辑 2023.01.19.
摘要:
在新冠病毒病(COVID-19)大流行之初,全球努力的重点是遏制病毒的传播和避免传染。目前,很明显,卫生专业人员应该处理COVID-19幸存者的整体健康状况。事实上,新的发现已经确定了新冠后遗症,其特征是营养不良、无脂肪质量(肌肉)减少和慢性低度炎症。此外,持续的功能障碍(即疲劳和肌肉无力、吞咽困难、食欲不振和味觉/嗅觉改变)以及心理困扰可能会使恢复变得复杂。因此,适当评估营养状况(评估膳食摄入、人体测量学和身体成分)是管理这些患者的支柱之一。另一方面,个性化的饮食建议代表了确保恢复的最佳策略。因此,本综述旨在收集有关营养素及其补充剂在新冠后遗症中的作用的现有证据,为营养师提供实用指南,为从COVID-19感染中恢复的患者量身定制营养干预方案。了解更多个性化的营养干预方案、相关产品信息等,可点击本网站专文:新冠后遗症 >>
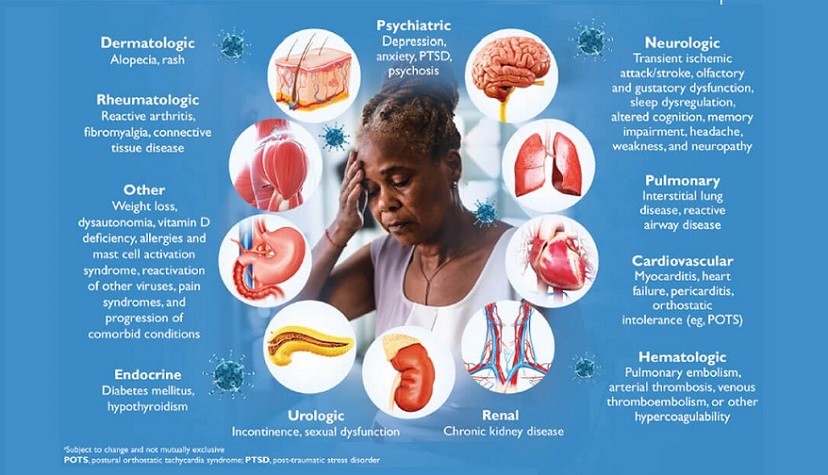
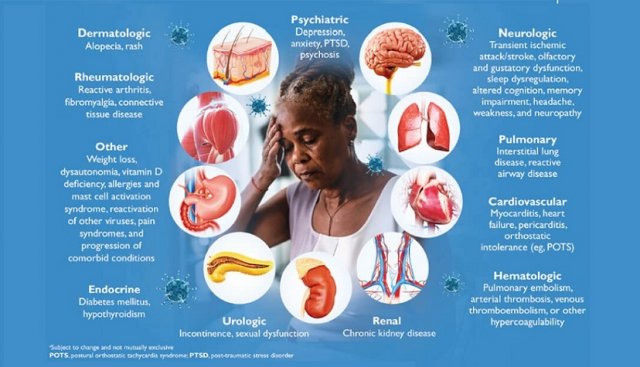
图1,新冠后遗症示意图(来源:互联网)
本文目录:
1. 导言
2. 研究方法
3. 营养对新冠后遗症患者的作用
3.1. 肌肉质量恢复和肌肉减少症
3.2. 肠道菌群的组成
3.3. COVID-19后疲劳综合症
4.营养师在新冠后遗症管理中的作用
5.新冠后遗症的饮食与营养建议
5.1. 能量摄入
5.2. 常量营养素
5.3. 微量元素
5.4. 营养保健品
5.5. 地中海饮食
6.总结既营养干预路径
1. 导言
自2020年03月新冠病毒(SARS-CoV-2)被WHO宣布为全球大流行以来,至今已造成全球超过10亿人感染以及数百万人死亡。根据广泛的报道,新冠病毒会引起多种临床表现,从无症状感染到轻度呼吸道疾病以及重症多器官衰竭和死亡,被通称为新冠病毒病(COVID-19)1 。 除了对肺部的影响外,现在人们对细胞代谢与病毒感染之间相互作用的了解越来越多,这会对炎症状态、血糖控制和血压等产生有害影响2。另一方面,越来越多的证据表明,肥胖及其并发症(即代谢综合征、胰岛素抵抗和2型糖尿病)与COVID-19感染的易感性和严重程度显著相关3,4 。因此,COVID-19感染的预后和恢复涉及多种因素。COVID-19引起的急性疾病和并发症已得到广泛研究。然而,到2020年中期,多项研究报告称,许多患者反映急性疾病后症状持续数周。目前,这种情况被称为COVID-19后综合症(Post-COVID-19 syndrome,简称新冠后遗症)。它通常被定义为:“在与COVID-19一致的感染期间或之后出现的体征和症状持续超过12周,并且无法通过替代诊断。”5 。新冠后遗症的发病率和患病率存在很大差异。然而,据报道,新冠后遗症在住院患者(85%)以及在门诊或在家接受治疗的个人 (10–35%) 中更常见6。因此,鉴于几项研究中报告的COVID-19相关并发症的持续发生率7,8,毫无疑问,新冠后遗症将成为医疗保健专业人员和国家卫生系统的负担。
更详细地说,新冠后遗症的特征是症状的组合,主要是疲劳和睡眠障碍9。其他常见特征包括呼吸困难、关节痛、焦虑、情绪低落、认知功能障碍、胸痛、血栓栓塞、脱发和慢性肾病9。这些症状的病理生理学可能与直接的病毒损伤、免疫/炎症后遗症以及医源性起源有关10。 对于器官特异性影响,已知COVID-19感染会导致严重的分解代谢性肌肉萎缩11。事实上,显著的全身炎症对肌肉蛋白质合成有负面影响,营养需求增加,由于新冠病毒感染引起的食欲、味觉和嗅觉丧失而难以满足12。因此,骨骼肌质量和功能丧失,即所谓的肌肉减少症,再加上由于虚弱、情绪低落和肠道微生物组变化造成的摄入不足,导致营养不良的发生率很高12 。营养不良本身会影响受新冠后遗症影响的所有其他系统的恢复,所以它是需要解决的关键组成部分。因此,营养师可以在新冠后遗症的早期发作以及患者随访中发挥关键作用,以改善结果。
当前的科学证据提供了有关新冠后遗症背后的病理生理机制的广泛信息,从而有助于确定营养干预的潜在目标13 。然而,对几项研究结果的解释具有挑战性,并且可能无法明确指示临床实践中的最佳解决方案。
因此,本综述主要参考Barrea等人在《Nutrients》2022.03发表的报告105,总结了关于营养素及其补充对新冠后遗症相关主要特征的作用的现有证据,目的还在于为临床实践中使用的新冠后遗症患者的管理提供实用指南。
2. 研究方法
本综述的采用的文献检索方法是通过在PubMed数据库中检索手稿(观察和临床研究、系统综述和荟萃分析)来进行的,这些手稿描述了过去10年中以英语发表的成人研究。研究中使用了术语“饮食或营养或营养素或饮食建议或保健品或生物活性化合物”、“COVID-19 后综合症或冠状病毒病或 COVID-19 或 SARS-CoV2”,结合布尔(Boolean)运算符“AND”。当获得新冠后遗症患者的非特异性证据时,开展了补充研究。更详细地说,关于营养管理对新冠后遗症以外的其他疾病患者的作用的证据,具有相似的病理生理机制和结果,暂时转移到符合新冠后遗症的临床和身体并发症的治疗。
这篇综述包括在“普通医学”或“内分泌和新陈代谢”或“营养与饮食”领域中影响因子最高的四分位期刊上发表的研究。排除了与每个感兴趣的问题无关的所有手稿105。
3. 营养对新冠后遗症患者的作用
营养可以在新冠后遗症的管理中发挥关键作用。事实上,多种饮食化合物可能对不同的目标产生多效性影响,从而通过独立和协同机制有助于缓解症状并促进身心健康,如下文所述。3.1. 肌肉质量恢复和肌肉减少症
肌肉减少症是一种进行性和全身性疾病,会导致肌肉质量和功能丧失14。这种疾病决定了力量下降、骨骼肌衰竭或机能不全。诊断采用逐步方法制定。第一步包括使用握力测试测量肌肉力量。作为该测试的结果,可以排除或怀疑肌肉减少症。疑似肌肉减少症需要通过使用其他测量肌肉质量的技术来确认,例如双能X射线吸收测定法(DXA)、生物电阻抗分析(BIA)、计算机断层扫描(CT)和磁共振成像 (MRI)14。
保持足够的肌肉质量和力量对健康生活很重要。已知在COVID-19期间会发生急性肌肉减少症,尤其是在老年患者中,这对COVID-19后的功能和恢复有直接影响。重症COVID-19患者使用的肠外类固醇也会增加肌肉蛋白质分解13 。因此,恢复肌肉质量的营养疗法是新冠病毒后遗症管理的一个重要方面。最近的一项系统回顾和荟萃分析评估了改善老年受试者肌肉质量、肌肉力量和身体表现的营养干预措施,得出的结论是,在阻力训练之上补充蛋白质可用于增加肌肉质量和力量15。根据该综述,健康老年受试者每日最低蛋白质需求量为每天每公斤体重0.83g优质蛋白质。
此外,羟甲基丁酸(HMB)或肌酸补充剂也有效,而亮氨酸(一种必需氨基酸)的使用提供了最佳证据15。这种干预(作为补充剂或以均衡饮食的形式)也可用于新冠后遗症患者的肌肉质量恢复,从而有利于更快的身体恢复。
3.2. 肠道菌群的组成
肠道菌群在宿主体内发挥着独特的代谢功能。事实上,微生物多样性减少和肠道生态失调最近与宿主慢性疾病(即炎症性肠炎、2 型糖尿病、心血管疾病和结直肠癌)有关16 。该研究并指出,肠道可以通过神经、炎症和激素信号通路与大脑进行交流,从而影响心理健康。COVID-19患者的肠道菌群组成发生了变化,尤其是在使用抗生素的情况下,这可能对身心健康产生短期和长期影响,包括恢复和发生新冠后遗症的严重程度17。研究表明,蛋白质、脂肪、可消化和不可消化的碳水化合物(益生元)、益生菌和多酚都会引起肠道微生物群组成的变化18,19 。例如,高脂肪饮食会减少已知与健康代谢状态相关的乳杆菌,而易消化和不易消化的碳水化合物会丰富双歧杆菌并抑制致病性梭状芽孢杆菌18。此外,益生菌和植物多酚的使用会引起肠道微生物群的健康变化18,19。 因此,含有支持健康微生物群的膳食化合物的均衡饮食将有助于促进新冠后遗症患者的身心健康。
3.3. COVID-19后疲劳综合症
最近的研究表明,很大一部分COVID-19患者患有长期的COVID-19后疲劳综合征,其症状类似于慢性疲劳综合症 (CFS) 20。其病理生理学很复杂,涉及自主神经功能障碍(植物神经紊乱)、内分泌紊乱和反应性情绪障碍(即抑郁或焦虑),以及遗传、环境和社会经济倾向20[23]。
目前,没有足够的高水平证据直接支持使用营养补充剂和改良饮食来缓解新冠后遗症患者的症状。然而,有证据支持某些营养素,包括维生素C、维生素B族、镁、锌、叶酸、辅酶Q10、左旋肉碱、色氨酸和必需脂肪酸等的缺乏似乎与增加的氧化应激有关21,它对CFS症状的严重程度和进展起重要作用。
最近,几项针对CFS患者的试验报告了抗氧化剂和脂质对减轻CFS症状的益处。事实上,糖磷脂-抗氧化剂-维生素的补充表明,使用Piper 疲劳量表 (PFS)测量的中度受试者的总体疲劳评分有所改善21。因此,包括必需脂肪酸和抗氧化剂在内的充足营养补充剂,或以均衡健康饮食的形式提供的营养补充剂,可能有助于控制/缓解 COVID-19 后疲劳综合症。
3.4. 饮食和单一营养素对心理健康的可能作用
除了对身体健康的影响外,新冠后遗症还会影响心理健康,包括焦虑、抑郁、创伤后应激障碍(PTSD)和认知障碍的发展22 。近年来,营养与心理健康之间的关系越来越受到关注。 流行病学研究表明,与高水果和蔬菜摄入量相关的抑郁症风险降低23。事实上,糖磷脂-抗氧化剂-维生素的补充表明,使用Piper疲劳量表(PFS)测量的中度受试者的总体疲劳评分有所改善23。而且,健康志愿者接触高血糖指数饮食的实验表明会增加抑郁症状的发生24。此外,研究还表明,地中海饮食可以减少炎症标志物,而大量摄入饱和脂肪和反式脂肪以及精制碳水化合物可能导致认知能力下降和海马体功能障碍,从而导致心理健康受损23,25
值得一提的是,脂质约占大脑干重的50-70%,大脑脂质环境的变化会导致受体和其他膜蛋白活性的功能改变,从而影响神经传递26。已经证明富含Omega-3脂肪酸(例如鱼油)的饮食会上调与维持动物突触功能和可塑性有关的基因,并增强人类的认知功能26。此外,Omega-3脂肪酸缺乏会增加患各种精神疾病的风险,并且它们对于维持心理健康很重要26 。因此,很明显,富含水果和蔬菜以及生物活性化合物成分(例如Omega-3脂肪酸),以及低反式脂肪和精制碳水化合物摄入量的整体健康饮食可以增强心理健康,可以在新冠病毒后遗症患者的恢复中发挥作用。
4.营养师在新冠后遗症管理中的作用
在COVID-19大流行之初,人们的注意力集中在遏制病毒的传播和避免传染上。现在,很明显,重点还应该放在COVID-19幸存者的健康状况上27。营养师在多学科团队中的作用非常重要。事实上,有据可查的是,患者的营养状况在很大程度上决定了COVID-19感染的演变28,以及其他情况,如伤口愈合缓慢、器官功能下降、心血管疾病和癌症等29,30。值得注意的是,许多文献都强调了对所有COVID-19患者进行正式营养评估的重要性31,32,33。事实上,长期住院的患者往往会出现营养不良和肌肉减少症,这主要是由于长时间的机械通气和不动34。在法国,Vaillant等人的研究表明,在COVID-19幸存的住院患者中,67%出现营养不良,出院后41%的患者仍存在营养不良35。
如果患者营养不足,则更易产生新冠后遗症32。除了慢性疲劳之外,营养问题还与中枢敏化有关,中枢敏化会产生对刺激的超敏反应,这会影响胃肠道,从而限制食物摄入36。 此外,厌食症可能会增加,并且可能会产生分解代谢,从而进一步加剧营养不良,影响患者的康复36。一些新冠后遗症可能需要肠内或肠外营养,而其他患者则需要合格的营养咨询来扭转营养不良和/或治疗既往存在的合并症37。在这些患者中,营养师必须进行全面的营养评估,从而得出准确的营养诊断。
指导营养师工作的首要行动之一是营养筛查的应用;这些工具使他们能够识别那些有营养不良风险的患者37。使用的筛查之一是营养不良筛查工具。该仪器的优点是可以快速应用和确定因食欲不振导致的摄入量减少,以及及时询问近期非自愿体重减轻38。营养与饮食学会指出,营养师对这类患者的评估应包括以下内容37。
(1). 营养史:营养素摄入量(常量和微量营养素)、能量和营养素摄入量是否充足、过去和现在的饮食史、宗教和文化偏好、食物不耐受和拒绝、食欲变化或习惯性摄入量。
(2). 人体测量:体重和身高,能够计算BMI、体腔估计(脂肪量、无脂量。该学会还建议分析生化数据、深入体检以及查询个人和家族史等方面。所有这些细节对于确定这些患者之前的炎症状态都很重要,因为据描述炎症在COVID-19患者39和其他疾病40,41中起着决定性作用。
除了体重指数BMI外,了解身体成分也很重要。使用的技术之一是生物电阻抗分析 (BIA)。它测量固定频率、单频或多频下低电流的生物阻抗。这种方法的原理是基于这样一个事实,即瘦肉组织是一种优良的电导体,因为它含有水和电解质,而脂肪是一种不良导体,因为它不含水42。这种技术可以估计脂肪量和肌肉量的百分比,从而评估它们随时间的变化。
如前所述,新冠后遗症患者出现肌肉减少症的风险很高。多种因素可以解释这种情况,包括既往医疗和营养状况以及厌食、低体力活动、心血管并发症和肠道微生物群43,44,45。对先前感染过冠状病毒的人进行的研究表明,感染后,身体机能和身体形态可能会在发病后长达两年内恶化46。 因此,必须使用步态速度、手柄和问卷调查等各种方法对其进行评估。使用的问卷之一是力量、行走辅助、从椅子上起身、爬楼梯和跌倒问卷 (SARC-F):该工具被证明具有中-高特异性,可以准确识别老年人的肌肉减少症47。患者必须通过对这些特征(助行器、力量、从椅子上站起来、爬楼梯和跌倒)进行评分来做出反应,然后加上分数并确定是否存在肌肉减少症48。另一个被广泛使用的工具是握力,可以显示整体肌肉力量、肌肉质量、步行表现和整体营养状况。低握力表明活动能力差,可以很好地预测低肌肉质量的临床结果49。
对普通人群和 COVID-19 患者的研究表明,这种大流行还导致睡眠质量差和失眠50。睡眠障碍可能由许多其他情况引起,例如肥胖、维生素D缺乏症51、阻塞性睡眠呼吸暂停52、荷尔蒙失衡和心境障碍等。因此,评估新冠后遗症患者的睡眠也很重要。为了对此进行评估,匹兹堡(Pittsburgh)睡眠质量指数53是一种广泛使用的工具。该工具评估一段时间(1个月)内的睡眠质量和干扰。估计睡眠的不同组成部分,然后得出一个分数,可以区分睡眠良好和睡眠不好的人54。
关于营养方法对COVID-19幸存者的重要性的文献铺天盖地。为此,营养师的作用至关重要;他/她必须通过病历、诊断测试和筛查收集足够的信息,以得出营养诊断,以便采取行动改善个人的健康状况和生活质量(如下表)。
新冠后遗症患者营养评估工具/程序汇总表。
| 目标 | 工具/程序 |
| 营养不良风险 | 营养不良筛查工具(膳食摄入量、食欲和非自愿体重减轻) |
| 饮食习惯 | 营养史(实际能量和营养摄入的充足性、宗教和文化偏好、食物不耐受和拒绝、既往饮食史、习惯摄入量的变化) |
| 人体测量学和身体成分 |
-体型(体重、身高和 BMI) -生物电阻抗分析(脂肪量、去脂量和肌肉量) |
| 肌肉减少症和功能障碍(疲劳和肌肉无力) |
-步态速度 -手柄 -特定问卷(即 SARC-F) |
| 身体损伤 |
记忆数据(吞咽困难、味觉/嗅觉改变) 生化参数(特别是炎症状态) |
| 睡眠障碍 | 匹兹堡睡眠质量指数 |
5.新冠后遗症的饮食与营养建议
如前几节所述,新冠后遗症患者的特征是营养不良、无脂肪质量(瘦体重)减少和轻度炎症。此外,恢复可能因持续的症状而复杂化,例如功能障碍(即疲劳和肌肉无力)、吞咽困难(特别是在住院期间插管的患者)、食欲不振和味觉/嗅觉改变(味觉障碍/味觉障碍和嗅觉丧失)55。 因此,新冠后遗症患者的营养治疗目标应侧重于纠正营养不足,以支持身体和功能状况以及心理健康方面的充分恢复。5.1. 能量摄入
新冠后遗症患者的能量需求取决于其实际营养状况。大多数人在 COVID-19 感染期间体重意外下降,原因是炎症增加、与味觉/嗅觉改变相关的食欲不振以及吞咽障碍。此外,患者在进食和饮水后可能会出现早饱感和饱胀感56,57。因此,纠正能量消耗和能量摄入之间的不平衡很重要。通过估计个人能量需求(根据年龄、性别和体重),可以建议患者增加食物摄入量的实用策略,例如少食多餐(每天六餐,每3小时吃一次零食)、饭后饮酒以避免早饱,并限制标有“清淡”、“低脂肪”或“低热量”的食物或饮料。可考虑使用即饮型小容量口服营养补充剂来增加能量摄入58。
然而,一些患者在COVID-19感染前超重/肥胖,而一些人在封闭期间因饮食习惯、压力、精神负担和身体活动的变化而体重增加59,60。证据表明,超重/肥胖患者在急性感染后出现更坏结果的风险更大61,并且更容易发生病毒感染62。另一方面,肥胖的特征是促炎状态、炎症细胞因子(即 IL-6 和肿瘤坏死因子-α)外流增加62。因此,提倡这类新冠后遗症患者减轻体重,以预防未来的病毒感染并减少与肥胖相关的亚临床炎症。
5.2. 常量营养素
新冠后遗症患者的蛋白质需求量应该更高,以防止肌肉减少症并避免肌肉量进一步消耗63。应建议患者摄入来自植物和动物来源的优质蛋白质,并根据体重摄入15-30g蛋白质/餐,以确保摄入所有必需氨基酸,这可能会发挥抗炎作用64,65。此外,一些研究表明,白天摄入蛋白质可能会阻止自噬66。 因此,在每餐和点心中加入蛋白质来源可能是有用的。此外,某些氨基酸,即精氨酸和谷氨酰胺,可能因其在调节免疫反应中的已知作用而得到补充65。
至于脂肪摄入量,建议每天摄入1.5-3g的Omega-3脂肪酸(EPA和DHA)以改善炎症。有趣的是,已经表明Omega-3 脂肪酸可能会抑制包膜病毒(例如 COVID-19)的病毒复制,从而可能降低新感染的风险67。此外,应增加特级初榨橄榄油的摄入量,以提供充足的单不饱和脂肪酸、生育酚和多酚摄入量,这些物质已被证明具有抗炎和抗氧化特性68。
最后,总碳水化合物摄入量并不是新冠后遗症患者的主要关注点。但是,强烈建议食用低升糖指数的碳水化合物来源。事实上,摄入高血糖指数的食物与炎症和氧化应激增加有关69,70 。 此外,粘性和可发酵纤维(即来自全麦的β-葡聚糖和阿拉伯木聚糖,来自水果、蔬菜和豆类的果胶)的摄入量应该增加,因为它对产生丁酸盐的细菌具有益生元作用,这与减少宿主的炎症相关71,72。
5.3. 微量元素
营养,尤其是微量元素和维生素在调节免疫力方面的作用,在大流行期间受到了极大关注。 事实上,一项初步研究评估了COVID-19住院患者的微量营养素状况,显示微量营养素缺乏,尤其是维生素D (76%) 和硒 (42%)73。
维生素D在减少感染方面的作用是通过多种机制发挥作用的。这些包括内源抗菌肽(Cathelicidins)和防御素(Defensins)的诱导,减少病毒的存活和复制,以及保持上皮层完好无损74。与COVID-19感染特别相关的因素包括降低促炎细胞因子浓度和增加血管紧张素转化酶2(ACE2)水平75。应该注意的是,维生素D补充剂对炎症和氧化应激指标的影响也在其他疾病中进行了研究,例如糖尿病76,77和高血压78,以及它对钙代谢的影响和广泛的非钙血症基因表达79。 另一种与低浓度25-羟基维生素D (25(OH)D) 相关的疾病是乳腺癌,因为这种维生素浓度越高,患乳腺癌的风险越低80。
值得注意的是,据报道,维生素D缺乏症在心血管疾病(CVD)患者中很常见81,82。在四项基于人群的队列研究中进行的孟德尔随机化分析发现,冠心病、中风和全因死亡率的结果与这种维生素的低血清浓度呈负相关83。Acharya等人观察到,在维生素D缺乏且无心肌梗死病史的患者中,一定水平的25(OH)D治疗与全因死亡风险显著降低相关84。
值得一提的是Schöttker等人进行的荟萃分析,其中在不同的队列研究中调查了血清25(OH)D浓度与死亡率之间的关联,个体因年龄、性别和国家而异。研究人员得出结论,尽管维生素D水平因国家、性别和一年中的季节而异,但25(OH)D水平与全因死亡率和特定原因死亡率之间存在一致的关联85。因此,很明显,维生素D水平对COVID-19患者可能存在的几种健康状况有重大影响;所以,他们的预后将比那些没有这种缺陷的人差。
Seal等人在2022年发表的队列研究中观察到,在总共4599名新冠病毒阳性患者中,25(OH)D的血清浓度与新冠肺炎相关的住院和死亡率呈反比剂量-反应关系86。在在其他出版物中也获得了类似的结果87,88,这些出版物分别得出结论认为这些也发生在合并症患者中89。
因此,ESPEN指南58和其他研究90建议患者摄入100%的每日推荐摄入(RDA)。需要更高的摄入量91,对于微量营养素缺乏症患者,应建议每天至少补充一次复合维生素和矿物质。国际营养建议表明维生素D摄入量 (400 IU) 的重要性,特别是对于阳光照射较少的患者(即长期隔离或住院)73, 92。
5.4. 营养保健品
除了上述营养素,其他生物活性化合物可能在减少炎症(免疫抑制剂)或改善免疫反应(免疫刺激剂)方面发挥关键作用。
在免疫抑制剂中,多酚类物质(槲皮素、白藜芦醇、茶多酚/绿茶提取物)、N-乙酰半胱氨酸 (NAC) 和十六酰胺乙醇 (PEA) 已证明其抗病毒活性,主要涉及抑制炎症通路(即NLRP3炎症小体介导的IL-β生成)、促炎细胞因子分泌以及病毒复制(通过抑制主要病毒蛋白酶)93。此外,补充肌醇可能会减少细胞因子风暴,这是COVID-19感染的特征91 ,可能在恢复过程中也起着关键作用。另一方面,炎症增加是氧化状态受损的结果。与具有抗氧化特性的维生素和矿物质相比,补充谷胱甘肽可改善多种组织的氧化损伤94。 因此,肌醇和谷胱甘肽的结合可以代表一种有用的策略,可以改善新冠后遗症患者的炎症和氧化状态。
至于免疫刺激剂,乳蛋白和多肽(牛乳铁蛋白、乳过氧化物酶、血清白蛋白、β-乳球蛋白和 α-乳清蛋白)已被用作有效的免疫增强剂93,尽管这种有益作用的潜在机制尚不完全清楚。此外,益生菌(即乳酸杆菌和双歧杆菌)可能会改善免疫反应,有利于与病原体竞争在肠道中定植并维持肠道屏障的完整性,从而降低对病原体及其微生物代谢物的渗透性95。
最后,一些营养化合物被提议作为免疫调节剂用于治疗COVID-19或减轻其症状。 Glychophosphopeptical (AM3) 是一种葡聚糖糖磷酸肽,可以调节先天免疫和适应性免疫96。水龙骨(Polypodium leucotomos)提取物以其对与免疫反应相关的不同途径的多效性作用而闻名97。谷氨酰胺是一种条件必需氨基酸,在调节 COVID-19 感染期间的“细胞因子风暴”中起着关键作用98。
5.5. 地中海饮食
越来越多的证据表明,饮食摄入(包括营养素和非营养性生物活性化合物)可以调节炎症和免疫系统。因此,将具有这些特性的不同食物组合在整个饮食模式中,可以作为新冠后遗症患者的有用营养方法。
地中海饮食的特点是许多具有抗炎和抗氧化活性的生物活性化合物(分别是单不饱和脂肪酸和Omega-3脂肪酸,以及维生素、矿物质和植物化学物质)29。事实上,几项研究证实了地中海饮食对与慢性低度炎症相关的几种疾病的抗炎和免疫调节作用99。有趣的是,观察性研究强调了坚持地中海饮食与COVID-19患者的更好结果(死亡率、康复率)以及不同人群感染COVID-19的风险之间的关联67,100,101,102。因此,建议食用更多植物性食物(水果、蔬菜、全麦和豆类)、优质动物蛋白(鱼、瘦肉、家禽、鸡蛋和低脂奶酪)以及作为脂肪主要来源的特级初榨橄榄油103。
最后,充足的水分(30 mL/kg实际体重)对于新冠后遗症患者的完全康复很重要104。 因此,这些患者应该通过饮用水、牛奶、果汁、肉汤、运动饮料、咖啡和茶来增加每日液体摄入量(2.5-3L/天)。
6. 总结既营养干预路径
总之,新冠后遗症患者需要对营养状况进行个性化评估,以检测潜在的营养和非营养缺乏症,并改善身心并发症和整体健康状况。在饮食方面,应建议患者食用富含抗炎和免疫刺激活性生物化合物的天然食物,例如地中海饮食。对于营养不良或缺乏的,应建议膳食补充剂或营养保健品。
尽管关于新冠后遗症患者营养管理的证据仍然很少,但本综述中报告的所有建议可能会有效影响新冠后遗症的主要病理生理机制(如图2所示)。然而,重要的是要强调,本综述中报告的一些信息是在针对具有相似结果的疾病治疗的研究中获得的,而不是专门针对 COVID-19 后综合症的研究。因此,需要对新冠后遗症患者进行更多的研究,以提供应对这种新型疾病的最佳临床方法。
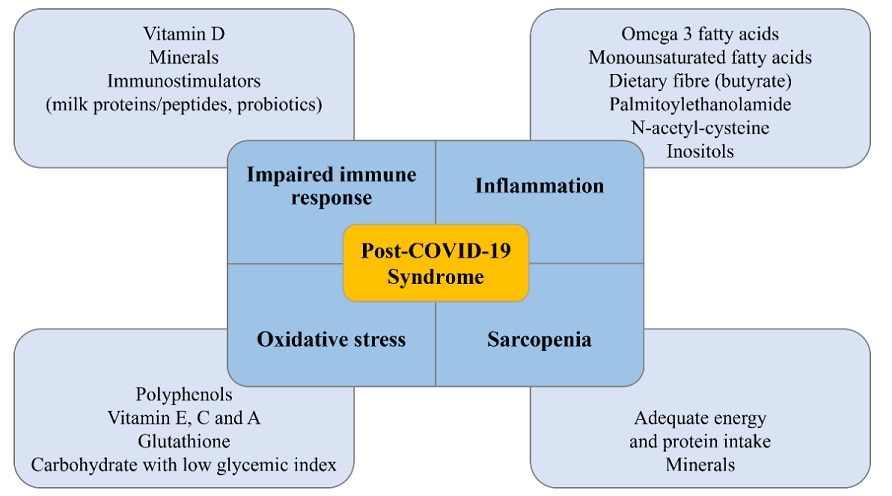
图2. 新冠后遗症患者膳食化合物的主要目标
主要的营养干预路径和可参考如下:
1. 改善氧化应激:
一般采用的营养素包括:维生素E、C和A,谷胱甘肽、植物多酚,例如:槲皮素、绿茶提取物、白藜芦醇等。
2. 抗炎、维持炎症与免疫平衡::
采用的营养素包括:欧米伽-3(鱼油)、益生元(尤其促产丁酸)、N乙酰半胱氨酸、肌醇、十六酰胺乙醇等。
3. 纠正免疫失衡、维持正常的免疫反应:
主要采用的营养素包括:维生素D、复合维生素矿物质、免疫刺激剂,例如:乳清蛋白、动植物混合蛋白、益生菌、水龙骨等。
4. 防止肌肉减少症:
主要采用营养素:乳清分离蛋白、动植物混合蛋白、复合维生素矿物质、肌酸、羟甲基丁酸等。
了解更多不同年龄的新冠后遗症、重症新冠感染后康复等个性化的营养干预方案、相关产品信息等,可点击:新冠后遗症 >>
后记:本综述根据现有文献翻译和编撰而成。由于新冠病毒感染仍未结束,新冠后遗症治疗和营养管理尚在发展中。本网站将根据最新发表的重要文献及时更新和补充。
参考文献:
1. Xu Z., Shi L., Wang Y., Zhang J., Huang L., Zhang C., Liu S., Zhao P., Liu H., Zhu L., et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir. Med. 2020;8:420–422.
2. Stefan N., Birkenfeld A.L., Schulze M.B., Ludwig D.S. Obesity and impaired metabolic health in patients with COVID-19. Nat. Rev. Endocrinol. 2020;16:341–342. doi: 10.1038/s41574-020-0364-6.
3. Sattar N., McInnes I.B., McMurray J. Obesity Is a Risk Factor for Severe COVID-19 Infection: Multiple Potential Mechanisms. Circulation. 2020;142:4–6.
4. Zhu L., She Z.G., Cheng X., Qin J.J., Zhang X.J., Cai J., Lei F., Wang H., Xie J., Wang W., et al. Association of Blood Glucose Control and Outcomes in Patients with COVID-19 and Pre-existing Type 2 Diabetes. Cell Metab. 2020;31:1068–1077.e3.
5. Augustin M., Schommers P., Stecher M., Dewald F., Gieselmann L., Gruell H., Horn C., Vanshylla K., Cristanziano V.D., Osebold L., et al. Post-COVID syndrome in non-hospitalised patients with COVID-19: A longitudinal prospective cohort study. Lancet Reg. Health Eur. 2021;6:100122.
6. Pavli A., Theodoridou M., Maltezou H.C. Post-COVID Syndrome: Incidence, Clinical Spectrum, and Challenges for Primary Healthcare Professionals. Arch. Med. Res. 2021;52:575–581.
7. Ayoubkhani D., Khunti K., Nafilyan V., Maddox T., Humberstone B., Diamond I., Banerjee A. Post-covid syndrome in individuals admitted to hospital with covid-19: Retrospective cohort study. BMJ. 2021;372:n693. doi: 10.1136/bmj.n693. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
8. Menges D., Ballouz T., Anagnostopoulos A., Aschmann H.E., Domenghino A., Fehr J.S., Puhan M.A. Burden of post-COVID-19 syndrome and implications for healthcare service planning: A population-based cohort study. PLoS ONE. 2021;16:e0254523.
9. Iqbal F.M., Lam K., Sounderajah V., Clarke J.M., Ashrafian H., Darzi A. Characteristics and predictors of acute and chronic post-COVID syndrome: A systematic review and meta-analysis. EClinicalMedicine. 2021;36:100899.
10. Song W.J., Hui C.K.M., Hull J.H., Birring S.S., McGarvey L., Mazzone S.B., Chung K.F. Confronting COVID-19-associated cough and the post-COVID syndrome: Role of viral neurotropism, neuroinflammation, and neuroimmune responses. Lancet Respir. Med. 2021;9:533–544.
11. Oronsky B., Larson C., Hammond T.C., Oronsky A., Kesari S., Lybeck M., Reid T.R. A Review of Persistent Post-COVID Syndrome (PPCS) Clin. Rev. Allergy Immunol. 2021;20:1–9.
12. Crispo A., Bimonte S., Porciello G., Forte C.A., Cuomo G., Montagnese C., Prete M., Grimaldi M., Celentano E., Amore A., et al. Strategies to evaluate outcomes in long-COVID-19 and post-COVID survivors. Infect. Agent. Cancer. 2021;16:62.
13. Piotrowicz K., Gąsowski J., Michel J.P., Veronese N. Post-COVID-19 acute sarcopenia: Physiopathology and management. Aging Clin. Exp. Res. 2021;33:2887–2898.
14. Cruz-Jentoft A.J., Sayer A.A. Sarcopenia. Lancet. 2019;393:2636–2646.
15. Gielen E., Beckwée D., Delaere A., De Breucker S., Vandewoude M., Bautmans I., Sarcopenia Guidelines Development Group of the Belgian Society of Gerontology and Geriatrics (BSGG) Nutritional interventions to improve muscle mass, muscle strength, and physical performance in older people: An umbrella review of systematic reviews and meta-analyses. Nutr. Rev. 2021;79:121–147.
16. Hills R.D., Jr., Pontefract B.A., Mishcon H.R., Black C.A., Sutton S.C., Theberge C.R. Gut Microbiome: Profound Implications for Diet and Disease. Nutrients. 2019;11:1613.
17. Dhar D., Mohanty A. Gut microbiota and Covid-19- possible link and implications. Virus Res. 2020;285:198018. doi: 10.1016/j.virusres.2020.198018.
18. Singh R.K., Chang H.W., Yan D., Lee K.M., Ucmak D., Wong K., Abrouk M., Farahnik B., Nakamura M., Zhu T.H., et al. Influence of diet on the gut microbiome and implications for human health. J. Transl. Med. 2017;15:73.
19. Vetrani C., Maukonen J., Bozzetto L., Della Pepa G., Vitale M., Costabile G., Riccardi G., Rivellese A.A., Saarela M., Annuzzi G. Diets naturally rich in polyphenols and/or long-chain n-3 polyunsaturated fatty acids differently affect microbiota composition in high-cardiometabolic-risk individuals. Acta Diabetol. 2020;57:853–860.
20. Sandler C.X., Wyller V., Moss-Morris R., Buchwald D., Crawley E., Hautvast J., Katz B.Z., Knoop H., Little P., Taylor R., et al. Long COVID and Post-infective Fatigue Syndrome: A Review. Open Forum Infect. Dis. 2021;8:ofab440.
21. Bjørklund G., Dadar M., Pen J.J., Chirumbolo S., Aaseth J. Chronic fatigue syndrome (CFS): Suggestions for a nutritional treatment in the therapeutic approach. Biomed. Pharm. 2019;109:1000–1007.
22. Shanbehzadeh S., Tavahomi M., Zanjari N., Ebrahimi-Takamjani I., Amiri-Arimi S. Physical and mental health complications post-COVID-19: Scoping review. J. Psychosom. Res. 2021;147:110525.
23. Lassale C., Batty G.D., Baghdadli A., Jacka F., Sánchez-Villegas A., Kivimäki M., Akbaraly T. Healthy dietary indices and risk of depressive outcomes: A systematic review and meta-analysis of observational studies. Mol. Psychiatry. 2019;24:965–986.
24. Salari-Moghaddam A., Saneei P., Larijani B., Esmaillzadeh A. Glycemic index, glycemic load, and depression: A systematic review and meta-analysis. Eur. J. Clin. Nutr. 2019;73:356–365.
25. Kastorini C.M., Milionis H.J., Esposito K., Giugliano D., Goudevenos J.A., Panagiotakos D.B. The effect of Mediterranean diet on metabolic syndrome and its components: A meta-analysis of 50 studies and 534,906 individuals. J. Am. Coll. Cardiol. 2011;57:1299–1313.
26. Lange K.W. Omega-3 fatty acids and mental health. Glob. Health J. 2020;4:18–30.
27. Klok F.A., Boon G., Barco S., Endres M., Geelhoed J., Knauss S., Rezek S.A., Spruit M.A., Vehreschild J., Siegerink B. The Post-COVID-19 Functional Status scale: A tool to measure functional status over time after COVID-19. Eur. Respir. J. 2020;56:2001494.
28. Wu C., Chen X., Cai Y., Xia J., Zhou X., Xu S., Huang H., Zhang L., Zhou X., Du C., et al. Risk Factors Associated with Acute Respiratory Distress Syndrome and Death in Patients with Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern. Med. 2020;180:934–943.
29. Barrea L., Altieri B., Muscogiuri G., Laudisio D., Annunziata G., Colao A., Faggiano A., Savastano S. Impact of Nutritional Status on Gastroenteropancreatic Neuroendocrine Tumors (GEP-NET) Aggressiveness. Nutrients. 2018;10:1854.
30. Altieri B., Barrea L., Modica R., Muscogiuri G., Savastano S., Colao A., Faggiano A. Nutrition and neuroendocrine tumors: An update of the literature. Rev. Endocr. Metab. Disord. 2018;19:159–167.
31. Zabetakis I., Lordan R., Norton C., Tsoupras A. COVID-19: The Inflammation Link and the Role of Nutrition in Potential Mitigation. Nutrients. 2020;12:1466.
32. Butler M.J., Barrientos R.M. The impact of nutrition on COVID-19 susceptibility and long-term consequences. Brain Behav. Immun. 2020;87:53–54.
33. Calder P.C. Nutrition, immunity and COVID-19. BMJ Nutr. Prev. Health. 2020;3:74–92.
34. Mechanick J.I., Carbone S., Dickerson R.N., Hernandez B., Hurt R.T., Irving S.Y., Li D.Y., McCarthy M.S., Mogensen K.M., Gautier J., et al. Clinical Nutrition Research and the COVID-19 Pandemic: A Scoping Review of the ASPEN COVID-19 Task Force on Nutrition Research. JPEN J. Parenter. Enteral. Nutr. 2021;45:13–31.
35. Vaillant M.F., Agier L., Martineau C., Philipponneau M., Romand D., Masdoua V., Behar M., Nesseler C., Achamrah N., Laubé V., et al. Food intake and weight loss of surviving inpatients in the course of COVID-19 infection: A longitudinal study of the multicenter NutriCoviD30 cohort. Nutrition. 2022;93:111433.
36. Gemelli Against COVID-19 Post-Acute Care Study Group Post-COVID-19 global health strategies: The need for an interdisciplinary approach. Aging Clin. Exp. Res. 2020;32:1613–1620.
37. Handu D., Moloney L., Rozga M., Cheng F.W. Malnutrition Care during the COVID-19 Pandemic: Considerations for Registered Dietitian Nutritionists. J. Acad. Nutr. Diet. 2021;121:979–987.
38. Ferguson M., Capra S., Bauer J., Banks M. Development of a valid and reliable malnutrition screening tool for adult acute hospital patients. Nutrition. 1999;15:458–464.
39. Maltezou H.C., Pavli A., Tsakris A. Post-COVID Syndrome: An Insight on Its Pathogenesis. Vaccines. 2021;9:497.
40. Barrea L., Marzullo P., Muscogiuri G., Di Somma C., Scacchi M., Orio F., Aimaretti G., Colao A., Savastano S. Source and amount of carbohydrate in the diet and inflammation in women with polycystic ovary syndrome. Nutr. Res. Rev. 2018;31:291–301.
41. Barrea L., Muscogiuri G., Laudisio D., Di Somma C., Salzano C., Pugliese G., de Alteriis G., Colao A., Savastano S. Phase Angle: A Possible Biomarker to Quantify Inflammation in Subjects with Obesity and 25(OH)D Deficiency. Nutrients. 2019;11:1747.
42. Smith S., Madden A.M. Body composition and functional assessment of nutritional status in adults: A narrative review of imaging, impedance, strength and functional techniques. J. Hum. Nutr. Diet. 2016;29:714–732.
43. Orio F., Muscogiuri G., Ascione A., Marciano F., Volpe A., La Sala G., Savastano S., Colao A., Palomba S. Effects of physical exercise on the female reproductive system. Minerva Endocrinol. 2013;38:305–319.
44. Barrea L., Muscogiuri G., Annunziata G., Laudisio D., Pugliese G., Salzano C., Colao A., Savastano S. From gut microbiota dysfunction to obesity: Could short-chain fatty acids stop this dangerous course? Hormones (Athens) 2019;18:245–250.
45. Barrea L., Muscogiuri G., Frias-Toral E., Laudisio D., Pugliese G., Castellucci B., Garcia-Velasquez E., Savastano S., Colao A. Nutrition and immune system: From the Mediterranean diet to dietary supplementary through the microbiota. Crit. Rev. Food Sci. Nutr.
2021;61:3066–3090.
46. Garrigues E., Janvier P., Kherabi Y., Le Bot A., Hamon A., Gouze H., Doucet L., Berkani S., Oliosi E., Mallart E., et al. Post-discharge persistent symptoms and health-related quality of life after hospitalization for COVID-19. J. Infect. 2020;81:e4–e6.
47. Nishikawa H., Asai A., Fukunishi S., Takeuchi T., Goto M., Ogura T., Nakamura S., Kakimoto K., Miyazaki T., Nishiguchi S., et al. Screening Tools for Sarcopenia. In Vivo. 2021;35:3001–09.
48. Ishida Y., Maeda K., Nonogaki T., Shimizu A., Yamanaka Y., Matsuyama R., Kato R., Ueshima J., Murotani K., Mori N. SARC-F as a Screening Tool for Sarcopenia and Possible Sarcopenia Proposed by AWGS 2019 in Hospitalized Older Adults. J. Nutr. Health Aging. 2020;24:1053–1060.
49. Yoo J.I., Choi H., Ha Y.C. Mean Hand Grip Strength and Cut-off Value for Sarcopenia in Korean Adults Using KNHANES VI. J. Korean Med. Sci. 2017;32:868–872.
50. Krishnamoorthy Y., Nagarajan R., Saya G.K., Menon V. Prevalence of psychological morbidities among general population, healthcare workers and COVID-19 patients amidst the COVID-19 pandemic: A systematic review and meta-analysis. Psychiatry Res. 2020;293:113382.
51. Muscogiuri G., Barrea L., Scannapieco M., Di Somma C., Scacchi M., Aimaretti G., Savastano S., Colao A., Marzullo P. The lullaby of the sun: The role of vitamin D in sleep disturbance. Sleep Med. 2019;54:262–265.
52. Pugliese G., Barrea L., Laudisio D., Salzano C., Aprano S., Colao A., Savastano S., Muscogiuri G. Sleep Apnea, Obesity, and Disturbed Glucose Homeostasis: Epidemiologic Evidence, Biologic Insights, and Therapeutic Strategies. Curr. Obes. Rep. 2020;9:30–38.
53. Mollayeva T., Thurairajah P., Burton K., Mollayeva S., Shapiro C.M., Colantonio A. The Pittsburgh sleep quality index as a screening tool for sleep dysfunction in clinical and non-clinical samples: A systematic review and meta-analysis. Sleep Med. Rev. 2016;25:52–73.
54. Buysse D.J., Reynolds C.F., 3rd, Monk T.H., Berman S.R., Kupfer D.J. The Pittsburgh Sleep Quality Index: A new instrument for psychiatric practice and research. Psychiatry Res. 1989;28:193–213.
55. Cereda E., Clavé P., Collins P.F., Holdoway A., Wischmeyer P.E. Recovery Focused Nutritional Therapy across the Continuum of Care: Learning from COVID-19. Nutrients. 2021;13:3293.
56. Caccialanza R., Laviano A., Lobascio F., Montagna E., Bruno R., Ludovisi S., Corsico A.G., Di Sabatino A., Belliato M., Calvi M., et al. Early nutritional supplementation in non-critically ill patients hospitalized for the 2019 novel coronavirus disease (COVID-19): Rationale and feasibility of a shared pragmatic protocol. Nutrition. 2020;74:110835.
57. Di Filippo L., De Lorenzo R., D’Amico M., Sofia V., Roveri L., Mele R., Saibene A., Rovere-Querini P., Conte C. COVID-19 is associated with clinically significant weight loss and risk of malnutrition, independent of hospitalisation: A post-hoc analysis of a prospective cohort study. Clin. Nutr. 2021;40:2420–2426.
58. Barazzoni R., Bischoff S.C., Breda J., Wickramasinghe K., Krznaric Z., Nitzan D., Pirlich M., Singer P., Endorsed by the ESPEN Council ESPEN expert statements and practical guidance for nutritional management of individuals with SARS-CoV-2 infection. Clin. Nutr. 2020;39:1631–1638.
59. Pellegrini M., Ponzo V., Rosato R., Scumaci E., Goitre I., Benso A., Belcastro S., Crespi C., De Michieli F., Ghigo E., et al. Changes in Weight and Nutritional Habits in Adults with Obesity during the “Lockdown” Period Caused by the COVID-19 Virus Emergency.
Nutrients. 2020;12:2016.
60. Bakaloudi D.R., Barazzoni R., Bischoff S.C., Breda J., Wickramasinghe K., Chourdakis M. Impact of the first COVID-19 lockdown on body weight: A combined systematic review and a meta-analysis. Clin. Nutr. 2021. in press . [PMC free article] [PubMed] [CrossRef]
61. Fedele D., De Francesco A., Riso S., Collo A. Obesity, malnutrition, and trace element deficiency in the coronavirus disease (COVID-19) pandemic: An overview.
Nutrition. 2021;81:111016.
62. Ellulu M.S., Patimah I., Khaza’ai H., Rahmat A., Abed Y. Obesity and inflammation: The linking mechanism and the complications. Arch. Med. Sci. 2017;13:851–863.
63. Ochoa J.B., Cárdenas D., Goiburu M.E., Bermúdez C., Carrasco F., Correia M. Lessons Learned in Nutrition Therapy in Patients With Severe COVID-19. JPEN J. Parenter. Enteral Nutr. 2020;44:1369–1375.
64. Paddon-Jones D., Rasmussen B.B. Dietary protein recommendations and the prevention of sarcopenia. Curr. Opin. Clin. Nutr. Metab. Care. 2009;12:86–90.
65. Fernández-Quintela A., Milton-Laskibar I., Trepiana J., Gómez-Zorita S., Kajarabille N., Léniz A., González M., Portillo M.P. Key Aspects in Nutritional Management of COVID-19 Patients. J. Clin. Med. 2020;9:2589.
66. Cannataro R., Carbone L., Petro J.L., Cione E., Vargas S., Angulo H., Forero D.A., Odriozola-Martínez A., Kreider R.B., Bonilla D.A. Sarcopenia: Etiology, Nutritional Approaches, and miRNAs. Int. J. Mol. Sci. 2021;22:9724.
67. El Khoury C.N., Julien S.G. Inverse Association Between the Mediterranean Diet and COVID-19 Risk in Lebanon: A Case-Control Study. Front. Nutr. 2021;8:707359.
68. Majumder D., Debnath M., Sharma K.N., Shekhawat S.S., Prasad G., Maiti D., Ramakrishna S. Olive Oil Consumption can Prevent Non-communicable Diseases and COVID-19: A Review. Curr. Pharm. Biotechnol. 2022;23:261–275.
69. Vetrani C., Costabile G., Di Marino L., Rivellese A.A. Nutrition and oxidative stress: A systematic review of human studies. Int. J. Food Sci. Nutr. 2013;64:312–326.
70. Monnier L., Mas E., Ginet C., Michel F., Villon L., Cristol J.P., Colette C. Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes. JAMA. 2006;295:1681–1687.
71. Salamone D., Rivellese A.A., Vetrani C. The relationship between gut microbiota, short-chain fatty acids and type 2 diabetes mellitus: The possible role of dietary fibre. Acta Diabetol. 2021;58:1131–1138.
72. Scheithauer T., Rampanelli E., Nieuwdorp M., Vallance B.A., Verchere C.B., van Raalte D.H., Herrema H. Gut Microbiota as a Trigger for Metabolic Inflammation in Obesity and Type 2 Diabetes. Front. Immunol. 2020;11:571731.
73. Cawood A.L., Walters E.R., Smith T.R., Sipaul R.H., Stratton R.J. A Review of Nutrition Support Guidelines for Individuals with or Recovering from COVID-19 in the Community. Nutrients. 2020;12:3230.
74. Grant W.B., Lahore H., McDonnell S.L., Baggerly C.A., French C.B., Aliano J.L., Bhattoa H.P. Evidence that Vitamin D Supplementation Could Reduce Risk of Influenza and COVID-19 Infections and Deaths. Nutrients. 2020;12:988.
75. Mercola J., Grant W.B., Wagner C.L. Evidence Regarding Vitamin D and Risk of COVID-19 and Its Severity. Nutrients. 2020;12:3361.
76. Mansournia M.A., Ostadmohammadi V., Doosti-Irani A., Ghayour-Mobarhan M., Ferns G., Akbari H., Ghaderi A., Talari H.R., Asemi Z. The Effects of Vitamin D Supplementation on Biomarkers of Inflammation and Oxidative Stress in Diabetic Patients: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Horm. Metab. Res. 2018;50:429–440.
77. Dawson-Hughes B., Staten M.A., Knower W.C., Nelson J., Vickery E.M., LeBlanc E.S., Neff L.M., Park J., Pittas A.G., D2d Research Group Intratrial Exposure to Vitamin D and New-Onset Diabetes Among Adults with Prediabetes: A Secondary Analysis From the Vitamin D and Type 2 Diabetes (D2d) Study. Diabetes Care. 2020;43:2916–2922.
78. Mirhosseini N., Vatanparast H., Kimball S.M. The Association between Serum 25(OH)D Status and Blood Pressure in Participants of a Community-Based Program Taking Vitamin D Supplements. Nutrients. 2017;9:1244.
79. Shirvani A., Kalajian T.A., Song A., Holick M.F. Disassociation of Vitamin D’s Calcemic Activity and Non-calcemic Genomic Activity and Individual Responsiveness: A Randomized Controlled Double-Blind Clinical Trial. Sci. Rep. 2019;9:17685.
80. McDonnell S.L., Baggerly C.A., French C.B., Baggerly L.L., Garland C.F., Gorham E.D., Hollis B.W., Trump D.L., Lappe J.M. Breast cancer risk markedly lower with serum 25-hydroxyvitamin D concentrations ≥60 vs <20 ng/mL (150 vs 50 nmol/L): Pooled analysis of two randomized trials and a prospective cohort. PLoS ONE. 2018;13:e0199265.
81. Dai L., Liu M., Chen L. Association of Serum 25-Hydroxyvitamin D Concentrations with All-Cause and Cause-Specific Mortality Among Adult Patients with Existing Cardiovascular Disease. Front. Nutr. 2021;8:740855. doi: 10.3389/fnut.2021.740855. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
82. Zhou A., Selvanayagam J.B., Hyppönen E. Non-linear Mendelian randomization analyses support a role for vitamin D deficiency in cardiovascular disease risk. Eur. Heart J. 2021:ehab809.
83. Emerging Risk Factors Collaboration/EPIC-CVD/Vitamin D Studies Collaboration Estimating dose-response relationships for vitamin D with coronary heart disease, stroke, and all-cause mortality: Observational and Mendelian randomisation analyses. Lancet Diabetes Endocrinol. 2021;9:837–846.
84. Acharya P., Dalia T., Ranka S., Sethi P., Oni O.A., Safarova M.S., Parashara D., Gupta K., Barua R.S. The Effects of Vitamin D Supplementation and 25-Hydroxyvitamin D Levels on the Risk of Myocardial Infarction and Mortality. J. Endocr. Soc. 2021;5:bvab124.
85. Schöttker B., Jorde R., Peasey A., Thorand B., Jansen E.H., Groot L.d., Streppel M., Gardiner J., Ordóñez-Mena J.M., Perna L., et al. Consortium on Health and Ageing: Network of Cohorts in Europe and the United States. Vitamin D and mortality: Meta-analysis of individual participant data from a large consortium of cohort studies from Europe and the United States. BMJ. 2014;348:g3656.
86. Seal K.H., Bertenthal D., Carey E., Grunfeld C., Bikle D.D., Lu C.M. Association of Vitamin D Status and COVID-19-Related Hospitalization and Mortality. J. Gen. Intern. Med. 2022;37:853–861.
87. Alcala-Diaz J.F., Limia-Perez L., Gomez-Huelgas R., Martin-Escalante M.D., Cortes-Rodriguez B., Zambrana-Garcia J.L., Entrenas-Castillo M., Perez-Caballero A.I., López-Carmona M.D., Garcia-Alegria J., et al. Calcifediol Treatment and Hospital Mortality Due to COVID-19: A Cohort Study. Nutrients. 2021;13:1760.
88. Entrenas Castillo M., Entrenas Costa L.M., Vaquero Barrios J.M., Alcalá Díaz J.F., López Miranda J., Bouillon R., Quesada Gomez J.M. Effect of calcifediol treatment and best available therapy versus best available therapy on intensive care unit admission and mortality among patients hospitalized for COVID-19: A pilot randomized clinical study. J. Steroid. Biochem. Mol. Biol. 2020;203:105751.
89. Gönen M.S., Alaylıoğlu M., Durcan E., Özdemir Y., Şahin S., Konukoğlu D., Nohut O.K., Ürkmez S., Küçükece B., Balkan İ.İ., et al. Rapid and Effective Vitamin D Supplementation May Present Better Clinical Outcomes in COVID-19 (SARS-CoV-2) Patients by Altering Serum INOS1, IL1B, IFNg, Cathelicidin-LL37, and ICAM1. Nutrients. 2021;13:4047.
90. Holick M.F., Binkley N.C., Bischoff-Ferrari H.A., Gordon C.M., Hanley D.A., Heaney R.P., Murad M.H., Weaver C.M., Endocrine Society Evaluation, treatment, and prevention of vitamin D deficiency: An Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2011;96:1911–1930.
91. Bizzarri M., Laganà A.S., Aragona D., Unfer V. Inositol and pulmonary function. Could myo-inositol treatment downregulate inflammation and cytokine release syndrome in SARS-CoV-2? Eur. Rev. Med. Pharmacol. Sci. 2020;24:3426–3432.
92. Grant W.B., Al Anouti F., Boucher B.J., Dursun E., Gezen-Ak D., Jude E.B., Karonova T., Pludowski P. A Narrative Review of the Evidence for Variations in Serum 25-Hydroxyvitamin D Concentration Thresholds for Optimal Health. Nutrients. 2022;14:639.
93. Singh S., Kola P., Kaur D., Singla G., Mishra V., Panesar P.S., Mallikarjunan K., Krishania M. Therapeutic Potential of Nutraceuticals and Dietary Supplements in the Prevention of Viral Diseases: A Review. Front. Nutr. 2021;8:679312.
94. Silvagno F., Vernone A., Pescarmona G.P. The Role of Glutathione in Protecting against the Severe Inflammatory Response Triggered by COVID-19. Antioxidants. 2020;9:624.
95. Basak S., Gokhale J. Immunity boosting nutraceuticals: Current trends and challenges. J. Food Biochem. 2021;46:e13902.
96. Fernández-Lázaro D., Fernandez-Lazaro C.I., Mielgo-Ayuso J., Adams D.P., García Hernández J.L., González-Bernal J., González-Gross M. Glycophosphopeptical AM3 Food Supplement: A Potential Adjuvant in the Treatment and Vaccination of SARS-CoV-2. Front. Immunol. 2021;12:698672.
97. Solivellas B.M., Martín T.C. Polypodium leucotomos Extract use to prevent and reduce the risk of infectious diseases in high performance athletes. Infect. Drug Resist. 2012;5:149–153.
98. Santos H.O., Tinsley G.M., da Silva G.A.R., Bueno A.A. Pharmaconutrition in the Clinical Management of COVID-19: A Lack of Evidence-Based Research But Clues to Personalized Prescription. J. Pers. Med. 2020;10:145.
99. Maiorino M.I., Bellastella G., Longo M., Caruso P., Esposito K. Mediterranean Diet and COVID-19: Hypothesizing Potential Benefits in People With Diabetes. Front. Endocrinol. (Lausanne) 2020;11:574315.
100. Greene M.W., Roberts A.P., Frugé A.D. Negative Association Between Mediterranean Diet Adherence and COVID-19 Cases and Related Deaths in Spain and 23 OECD Countries: An Ecological Study. Front. Nutr. 2021;8:591964.
101. Perez-Araluce R., Martinez-Gonzalez M.A., Fernández-Lázaro C.I., Bes-Rastrollo M., Gea A., Carlos S. Mediterranean diet and the risk of COVID-19 in the ‘Seguimiento Universidad de Navarra’ cohort. Clin. Nutr. 2022 Dec;41(12):3061-3068.
102. Ponzo V., Pellegrini M., D’Eusebio C., Bioletto F., Goitre I., Buscemi S., Frea S., Ghigo E., Bo S. Mediterranean Diet and SARS-COV-2 Infection: Is There Any Association? A Proof-of-Concept Study. Nutrients. 2021;13:1721.
103. Suardi C., Cazzaniga E., Graci S., Dongo D., Palestini P. Link between Viral Infections, Immune System, Inflammation and Diet. Int. J. Environ. Res. Public Health. 2021;18:2455.
104. Wotton K., Crannitch K., Munt R. Prevalence, risk factors and strategies to prevent dehydration in older adults. Contemp. Nurse. 2008;31:44–56.
105. Barrea L et al. Dietary Recommendations for Post-COVID-19 Syndrome. Nutrients. 2022 Mar; 14(6): 1305.

