既可预防又能降低新冠感染重症,这款营养品为什么被欧美医生所采用?
来源:本网编辑 2023.01.16.
本文目录:
前言
1.新冠病毒感染生理病理机制
2.NAC,一种被遗忘的免疫调节剂?
3.NAC用于预防和治疗COVID-19的证据
4.NAC治疗COVID-19患者病例报告和临床试验
5.NAC给药途径和剂量
6.NAC使用方法/策略
7.总结
8.Reference
前言
根据疾病预防控制中心称,大多数新冠病毒(SARS-Cov-2)感染者可以在家中康复。但是,这种病毒也可能导致免疫力低下的人、老年患者以及患有心血管疾病、糖尿病等基础疾病的人患上严重并发症1。急性呼吸窘迫综合征(ARDS)是COVID-19患者死亡的主要原因,与病毒感染后失调的宿主免疫反应有关2。病毒感染期间的早期免疫反应之一是免疫细胞产生细胞因子和趋化因子。已在受感染患者早期检测到高水平的白细胞介素IL-8(一种强烈的中性粒细胞化学引诱剂)3。一旦被感染激活,中性粒细胞会迅速募集到肺部炎症部位,产生和分泌细胞因子、酶,包括弹性蛋白酶(NE)以及活性氧(ROS),最终释DNA形成中性粒细胞胞外陷阱 (NETs)4。在重症COVID-19患者中,中性粒细胞数量增加与疾病严重程度相关,大多数是由于产生大量促炎细胞因子,造成“细胞因子风暴”(或“炎症风暴”)5。
在中性粒细胞中,NE可以降解多种结构和功能上重要的分子,例如凝血因子和补体蛋白6。NE活性可能部分解释了在COVID-19患者中观察到的肺出血的显著增加2。此外,NETs结合的NE可以降解局部纤溶酶原,而不会在纤维蛋白上产生纤溶酶,从而导致纤维蛋白溶解受损。这表明结合NE的NETs有潜力作为激活和形成血管内凝血的平台7,8,这部分解释了为什么肺栓塞通常发生在重症监护病房(ICU)的重症患者身上9。在一些重症COVID-19患者中,观察到血栓形成和出血并存10,这表明通过稳定中性粒细胞来抑制NE的产生可能对这两种情况都有好处。例如,通过IL-8抗体抑制中性粒细胞活化可以有效对抗急性肺损伤11,12。因此,任何可以抑制中性粒细胞活化的措施都可能改善 COVID-19 患者的预后。
宿主对抗病毒感染也需要细胞免疫,而病毒感染受氧化-抗氧化平衡的调节。这种平衡由包括谷胱甘肽(GSH)在内的抗氧化剂维持13。在老年人或免疫受损个体的免疫细胞中,活性氧(ROS)由于谷胱甘肽减少而增加,这会导致免疫反应失调,尤其是T细胞介导的功能失调。这可以解释老年人因感染性疾病(如肺炎)而导致的细胞介导免疫力低下和死亡率增加的原因14。事实上,除了功能低下之外,CD4+和CD8+ T细胞等淋巴细胞数量,被发现随年龄老化而线性下降15。此外,在重症COVID-19患者中,观察到细胞凋亡导致T细胞数量减少,这进一步损害了细胞免疫力,并与这些人群的较高死亡率有关2,16。因此,补充某些细胞抗氧化剂可以通过抑制T细胞凋亡来恢复免疫细胞的正常反应,从而可能降低病毒感染引起的肺炎的发生率或严重程度。
结合中性粒细胞和淋巴细胞的计数变化,几个研究小组最近发现,较高的中性粒细胞与淋巴细胞比率(NLR)预示着COVID-19患者的疾病会更严重,预后更差17,18,这表明NLR可能是在急性COVID-19感染期间用作预后标志物和治疗指南。因此,除了给予抗病毒药物外,抑制中性粒细胞活化和保护T细胞可以为治疗COVID-19患者提供有效的治疗选择。
新冠病毒感染生理病理机制
1.新冠病毒感染与氧化应激SARS-CoV-2(新冠病毒)进入呼吸道后,通过其刺突(S)蛋白与细胞膜表面的血管紧张素转换酶(ACE2)受体结合,附着在鼻腔和支气管上皮细胞和肺细胞上。随后,宿主细胞中表达的跨膜丝氨酸蛋白酶2型(TMPRSS2)通过蛋白水解促进病毒进入靶细胞19。ACE2也在血管内皮、心脏、肺脏、肾脏、肠道和神经系统等其他组织中显著表达20。病毒复制和细胞间传播抑制ACE2的表达,ACE2在肾素-血管紧张素-醛固酮系统(RAAS)中起重要作用,作为关键的反调节成分。这系列作用导致大量的活性氧生成和血管内皮损伤21。因此,氧化应激与COVID-19患者的严重临床结局和血栓事件相关22。
2.免疫系统对新冠病毒感染的反应
感染最初由先天免疫系统介导,其中有树突状细胞、NK 细胞和巨噬细胞参与。SARS-CoV-2被Toll样受体(TLR)-3等检测到,触发细胞内信号级联反应,最终激活NF-kB和干扰素 (INF) 等因子,从而改变细胞防御机制。这些因子促进效应细胞的募集和关键细胞因子如IL-6、TNF-α、IL-1β 的释放,以及半胱天冬酶的激活。这些作用于靶细胞的促炎细胞因子会增加转录因子NK-kB的激活,并产生正反馈,如果不加以控制,最终会产生“细胞因子风暴”23。这种强烈的炎症反应在急性呼吸窘迫综合征(ARDS)发病机制中起着关键作用 24,而中性粒细胞胞外陷阱(NETs)可引发微血管血栓形成,导致肺、心脏和肾脏受损。
NAC,一种被遗忘的免疫调节剂?
N-乙酰半胱氨酸(NAC)是抗氧化剂谷胱甘肽的前体物,数十年来在临床上常用于溶解肺部粘液(化痰)和治疗扑热息痛过量。然而,NAC还可以增强免疫系统、抑制病毒复制和减少炎症。尽管有这些有价值的特性,但在COVID-19大流行初期,NAC大多被忽视了。1997年7月,据《欧洲呼吸期刊》报道,De Flora 等人证明口服NAC(600mg,2次/天)可显著提高细胞介导的免疫力,使老年人从无反应状态转变为正常反应状态(图1A)25。无反应状态表示免疫细胞对外来物缺乏反应 ,例如细菌和病毒。正如预期的那样,NAC治疗显著降低了流感的发生频率,以及大多数症状的严重程度和持续时间(图1B)。尽管流感病毒(H1N1)的感染率在两组中相似,但NAC组中只有25%的病毒感染受试者出现流感症状,而安慰剂组中这一比例为79%。
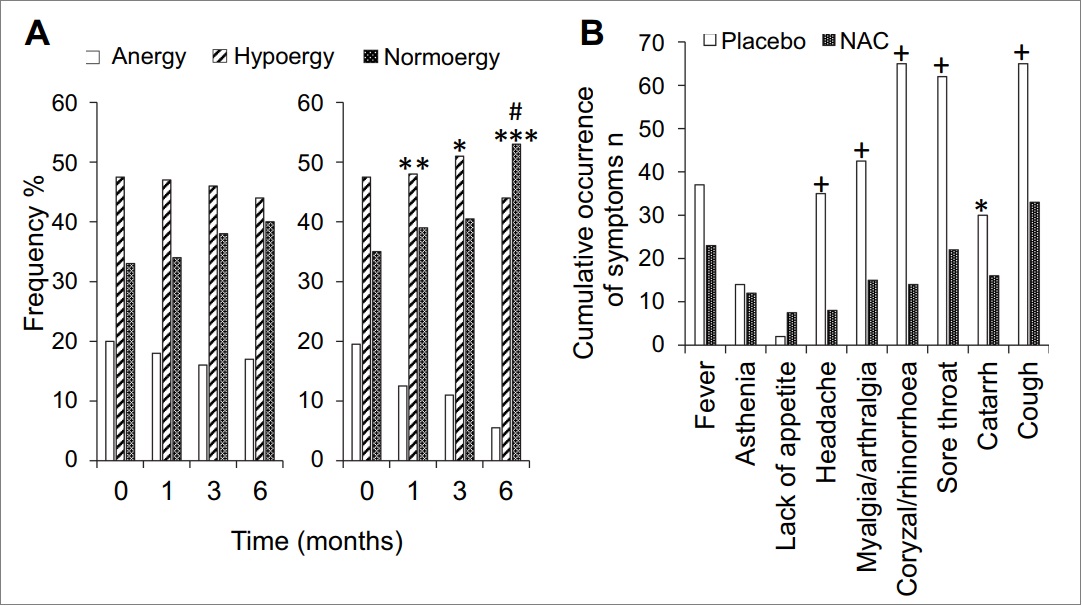
图1.(A)NAC治疗对细胞免疫的影响。 左:安慰剂组; 右图:NAC 治疗组。
(B)NAC治疗对个体流感样体征和症状累积发生的影响。
(B)NAC治疗对个体流感样体征和症状累积发生的影响。
因此,NAC可能会改善受损的细胞免疫力并防止某些呼吸道病毒引起的疾病的发展,从而提出一个问题:NAC给药能否使 COVID-19 患者受益?
NAC用于预防和治疗COVID-19的证据
1.NAC抗病毒作用RNA病毒(包括新冠病毒)需要宿主细胞内活跃的NF-κB通路支持才能复制。对于人类冠状病毒(HCoV-229E),抑制NF-κB会显著降低复制率26。因此,抑制NF-κB激活的药物可能会减少病毒复制。
已证明NAC以剂量依赖性方式(5至15mM)抑制NF-κB以及人流感病毒(H5N1)在人肺上皮细胞中的复制。NAC还减少了促炎细胞因子(IL-8、CXCL10等)产生,从而减少了单核细胞的趋化性迁移27。此外,NAC还被证明可以抑制其他病毒的复制,例如人类免疫缺陷病毒(HIV)28和呼吸道合胞病毒(RSV)等29。这意味着,理论上NAC具有抑制SARS-Cov-2的潜力,因为它能够负向调节NF-κB。
2.NAC直接抑制新冠病毒
抑制ACE2并降低SARS-CoV-2对其受体的亲和力。SARS-CoV-2通过与ACE2受体结合进入细胞内部来感染内皮细胞30。ACE2受体存在于细胞表面并竞争相同的底物血管紧张素 II。血管紧张素II和ACE2之间的平衡因人而异,但如果ACE2普遍存在,则可能会出现更多炎症。SARS-CoV-2感染下调细胞表面ACE2的丰度,导致血管紧张素 II 过度毒性积累,从而导致呼吸衰竭和心肌炎31。来自 NAC的硫醇阻断ACE2,从而阻碍SARS-CoV-2 渗透到细胞中32。
在COVID-19患者中观察到的肺泡损伤、血栓形成和红细胞失调可能是过度氧化应激的原因33。口服NAC为肝脏提供更多的半胱氨酸和以合成增加GSH水平,从而降低氧化应激34。这种情况尤其发生在老年人身上,因为血浆中的半胱氨酸水平会随着年龄的增长而降低。
3.NAC抗氧化与免疫调节
已经证明,NAC可以通过补充还原型谷胱甘肽(GSH)来改变中性粒细胞内的氧化还原平衡,使其向还原状态转变,GSH在10mM或更高的浓度下抑制NF-κB活化,从而调节细胞因子的产生和趋化信号35。此外,服用NAC(每天600mg)14天的健康志愿者的嗜中性粒细胞表现出较低的氧化爆发率和趋化性。临床可获得的NAC浓度也可抑制单核细胞的趋化性36。
值得注意的是,NAC并未损害中性粒细胞的其他功能,例如吞噬作用和细菌杀灭37。总的来说,该数据支持这样一种观点,1200mg口服NAC可以有效减少活性氧(ROS)的产生,但不会损害嗜中性粒细胞对新冠病毒的吞噬作用。
在重症COVID-19患者中,SARS-cov-2感染经常导致淋巴细胞减少,尤其是T细胞38。NAC可以增加人类T细胞内的GSH,并阻断在HIV、HCV和流感等病毒感染期间诱导的凋亡39。在慢性炎症性疾病期间,每天2次口服NAC 1200mg可快速增加淋巴细胞中的谷胱甘肽水平,而低剂量NAC(1200mg)无法实现这一点40。因此,大剂量口服NAC(1200mg,2次/天)除了在 COVID-19 发展过程中调节中性粒细胞功能外,还可以通过提高淋巴细胞中的GSH水平来增强适应性免疫。
主要细胞内抗氧化剂GSH的内源性衰竭和GSH还原酶的增加可能是COVID-19重症和死亡的基础。在SARS-CoV-2感染的早期阶段,NAC 可以通过两种方式恢复正常水平的炎症反应41。一个重点是通过抑制 T 细胞凋亡来恢复正常的免疫细胞反应,这可能会降低与病毒感染相关的肺炎的发生率或严重程度。另一个基于这样一个事实,即鉴于在该疾病的严重病例中观察到低水平的 GSH,寻求恢复GSH水平的方法以保护最脆弱的人群将是非常重要的41。
4.NAC降低肺炎的发病率
鉴于口服NAC(600mg,2次/天)可显著降低流感的发生频率和严重程度,口服 NAC也可降低肺炎的发生率。一项研究表明,大约37%的机械通气患者在重症监护病房中发生肺炎,即呼吸机相关肺炎(VAP)。与安慰剂组患者相比(26.6% VS 46.6%),经NAC(600mg,2次/天)治疗的患者出现临床确诊肺炎的情况明显减少42。另一项研究表明,口服NAC(600mg,2次/天)显著降低了TNF和丙二醛(MDA)的水平,并显著改善氧化应激43。用抗氧化剂调节炎症过程可能对肺炎的发展有缓解作用,如果使用高剂量的NAC(1200mg,2次/天),可能会改善结果。
5. 静注NAC改善肺功能并降低死亡率
病毒引起的“细胞因子风暴”与COVID-19患者的死亡率密切相关44。除了分泌细胞因子外,中性粒细胞还会产生ROS。ROS是具有化学活性的含氧物,如超氧化物、过氧化物、羟基自由基、单线态氧和α-氧等。超氧阴离子自由基 (O2-) 可直接造成伤害,并可转化为更具破坏性的氧化剂,如羟基自由基 (OH-) 和次氯酸 (HOCl)45。在这两者中,OH-已被证明是在急性肺损伤期间引起肺水肿的关键活性氧46。继发于成人ARDS和肺动脉高压的低氧血症COVID-19感染期间可能会出现水肿47。除了引起组织损伤外,ROS还可以激活NF-kB通路,通过上调多种基因来放大炎症。NAC是一种强大的OH-清除剂,可有效预防细胞因子风暴和ROS引起的肺水肿和呼吸衰竭48。
对于因多种基础疾病导致轻度至中度急性肺损伤患者中,静注NAC治疗(40mg/kg/天)3天可显著改善全身氧合,减少对通气支持的需求,并降低死亡率。这表明可以给予更高浓度的静脉注射NAC,从而可能改善临床结果49。在早期感染性休克患者中,NAC能够减少IL-的产生,改善氧合和肺顺应性并缩短ICU住院时间50。
一份病例报告揭示了NAC治疗对流感(H1N1)感染性休克患者的重要性。与奥司他韦一起,以100mg/kg/天的剂量静脉输注NAC 3天,可迅速改善患者的脓毒症状况,并消除肺部浸润。不过,患者在停止输注NAC后复发。然后,恢复输注相同剂量的NAC,患者病情再次迅速好转,直至病毒最终被根除,患者出院51。该病例表明,NAC的高浓度和足够的暴露时间是治疗病毒引起的危重症的关键,包括肺炎介导的败血症。
另一项有希望的研究表明,在ARDS和急性肺损伤(ALI)患者中,第一天以150mg/kg的剂量静脉注射NAC,然后以50mg/kg/天的剂量持续3天,不仅改善了氧合,而且与对照组患者相比,死亡率降低(35.7% vs 76.9%) (p<0.05)52。虽然这个队列研究相对较小,但其结果是显而易见的。这进一步提示,如果给予足够的剂量和治疗时间,静注NAC可用于治疗重症COVID-19并降低死亡率。
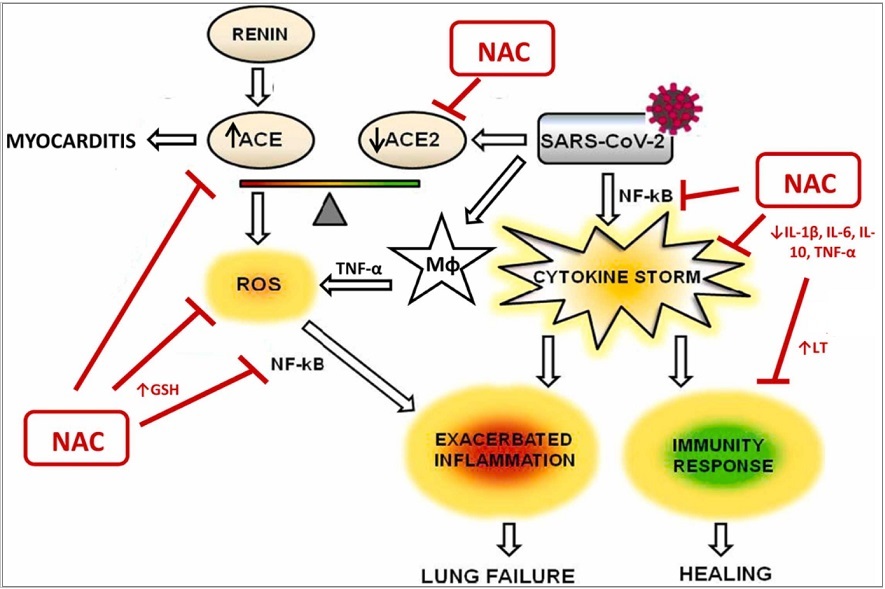
图2,NAC在新冠病毒感染中的潜在机制示意图
NAC治疗COVID-19患者病例报告和临床试验
综上所述,当 COVID-19大流行开始时,已经确定活性氧(ROS)在炎症反应和病毒复制中起着核心作用,而发挥抗病毒和抗炎作用的抗氧化剂NAC也可能对治疗细胞因子风暴有效。在SARS-Cov-2大流行之前,NAC在ARDS中的作用存在争议。一项针对评估NAC对ARDS患者疗效的对照临床试验的系统评价和荟萃分析,包括八项试验,共289名患者53。与对照组相比,NAC 治疗并未降低总死亡率,但对ICU住院时间产生有益影响。就在COVID-19宣布为大流行病之前,Cochrane对48项对照临床试验进行了审查,其中6299名患者接受了包括NAC在内的不同药物治疗,得出的结论是,没有足够的证据确定皮质类固醇、表面活性剂、NAC、他汀类药物和其他药物可有效降低ADRS患者的死亡率54。鉴于使用NAC是有理由的,特别是由于在大流行初期缺乏有效的治疗方法,并且其安全性极佳,因此建议将NAC用于具有较高重症风险的患者COVID-19 32。最初的支持证据主要限于对临床病例的描述。随后,在一项队列研究中,Ibrahim 等人证明55,静注NAC可使10名38至71岁的重度 COVID-19机械通气患者出现临床改善。NAC可显著降低各种炎症标志物,例如CRP和铁蛋白。最终,8名患者出院,其余2 名患者在该文献发表时有临床改善。该临床实践进一步证明了NAC在COVID-19治疗中的有效性。
在一份病例报告中,一名64岁的男性COVID-19患者在入院后第13天出现呼吸衰竭,尽管接受了抗生素、抗病毒和呼吸支持治疗。与其他治疗一起,大剂量(10-15g)NAC重复吸入11天显著改善了其危急状况。经过26天的机械通气和46天的住院治疗后,该患者最终出院56。另外二名呼吸困难的COVID-19患者通过口服和静注谷胱甘肽、NAC和α-硫辛酸得到有效治疗,57。这进一步提示氧化应激的补救可以成为抗击COVID-19的关键措施。
多项研究发现,NAC给药更长时间会产生积极的结果。在一项招募了46名COVID-19 相关肺炎患者的随机研究中,Gaynitdinova等人分析了在标准治疗中加入NAC(静注 1200-1500mg)的效果58。用NAC 治疗的组表明血氧饱和度显著增加,CRP值和住院时间减少,并伴随着CT扫描评估的肺部病变减少。回顾性评估了每12小时口服 600mg 剂量的NAC持续14天的疗效,以预防ARDS(PO2/FiO2 <150)、机械通气的需要以及第14天和第28天的死亡率59。 在接受NAC治疗的组中(82名患者中有42名患者),与未使用NAC的组相比,观察到ARDS的发展、机械通气的需要和死亡率在统计学上显著降低。这种改善伴随着更好的氧合和炎症标志物的减少,例如白细胞数量、CRP 或 D-二聚体值,推测抗炎作用是这种临床益处的原因59。
Frades等人60检查了274名因SARS-CoV-2引起的肺炎而入住中级呼吸监护病房的严重呼吸衰竭患者。他们的结果与之前的数据一致,因此皮质类固醇和抗凝剂与更好的结果相关。虽然在调整后的模型中没有统计学意义,但作者发现NAC对生存有好处,认为这可能是由于分泌密度的改善及其抗氧化作用。同样,最新发表的Avdeev 等人进行的病例对照研究表明61,静注NAC(1200–1800mg/天)可显著改善COVID-19患者的氧合参数和CRP降低、临床恶化和住院时间。
NAC给药途径和剂量
1.NAC口服给药肠道是人体最大的免疫器官,携带着体内所有淋巴细胞的70%。口服NAC后被小肠吸收,与上皮细胞和免疫细胞相互作用,可能增强免疫系统以抵抗病毒感染62。 一粒600mg NAC胶囊在给药后半小时内可达到外周血液中16μM的NAC水平。尽管几十年来它一直被贴上“低生物利用度”的标签,但如果在扑热息痛过量后8-10小时内服用,口服NAC会显示出与静脉注射(IV)途径相同的解毒能力63。
2.IV输注NAC
根据美国FDA批准的3袋方案(3-bag regime)治疗成人对乙酰氨基酚过量,NAC(分子量:163)静脉内给药,最初150mg/kg在200mL 5%葡萄糖中持续60分钟(第一袋),然后50mg/kg在500mL 5%葡萄糖中持续4小时(第二袋),最后在100mg/kg在1000mL 5%葡萄糖中持续16小时(第三袋)64。考虑到美国男性(20岁或年长者)平均体重约90公斤,血液约7000ml,1小时内可输注13.5g NAC溶于200ml(414mM)的5%葡萄糖液中。根据两项研究的计算64,65,在第一袋输注期间,血液中NAC的近似浓度应约为1mM,这足以中和强氧化剂种类,抑制氧化爆发,并显著降低中性粒细胞趋化性和细胞因子风暴。
3. 吸入剂
根据美国FDA指南,为了溶解粘液,梅奥(MAYO)诊所建议使用雾化器吸入3至5mL的20%溶液或6至10ml的10%溶液,每天三到四次。对于NAC,10%相当于613mM。高浓度NAC可有效减少病毒复制,显著减轻肺细胞损伤,以及过度免疫反应。
NAC使用方法/策略
- 预防:为了保护那些没有感染新冠病毒的个体(包括密接者),口服NAC(600mg x 2次/天)是一种有效且经济的措施,可以调节其免疫系统防止潜在的感染。
- 一旦出现发热、干咳等症状,可口服NAC(1200mg x 2次/天)缓解症状,抑制病毒复制、防止并发症,以及加速感染后恢复。
- 对于没有气道阻塞的相对严重的患者,NAC吸入剂可以与雾化器一起使用。过敏或哮喘患者应在吸入NAC之前或期间服用抗组胺药,以防止不良反应。
使用口服或吸入NAC进行自我治疗可以帮助许多感染SARS-Cov-2 的患者在家中安全康复。
- 一旦患者出现临床确诊的肺炎或呼吸困难,除了常规治疗(如瑞德西韦)53/66外,还应间歇或连续给予静脉注射NAC。这可以防止急性呼吸窘迫综合征(ARDS)的发展,ARDS通常需要有创通气和重症监护室支持。例如,NAC可以以100mg/kg 的剂量输注至少3天,这相当于3袋方案期间总剂量的约1/3。间歇和连续输注NAC在患者预后方面没有差异。 54/67
- 当患者出现ARDS时,在接受常规抗病毒治疗的同时,第一天150mg/kg,随后至少3天以100mg/kg/天的剂量给药,以避免不可逆的致命性多器官衰竭(MOF )。 一旦发生 MOF 或严重败血症,患者可能无法从任何NAC给药途径中获益。55/68
总结
NAC于1963年获得美国FDA批准为药物,主要用于溶解肺粘液和解毒扑热息痛过量。此外,还作为膳食补充剂而广受欢迎。NAC可能有助于控制RNA病毒,包括流感和冠状病毒69。几近60年的各种临床病症预防和治疗经验证实了NAC的安全性,即使在非常高的剂量和长期治疗下也是如此。药物再利用是在新药物可用之前针对 COVID-19 进行有效和可及治疗的最快策略,与具有单一靶点的药物相比,通过多种作用机制发挥作用的分子(例如 NAC)更有可能有效 。基于大量的研究和临床实践前提,NAC可被提议用于 COVID-19 的预防和治疗。特别是,出于预防目的,可能建议每天2次口服NAC,剂量为 600mg,目的是降低流行期间发生COVID-19的风险及其严重程度。正如之前在流感和流感样病例中所证明的那样25,特别是在老年人和患有慢性病的人中,这些基础病人群易患感染并加重其严重程度,以及与感染新冠病毒患者的密接者等,可能是口服NAC以降低感染风险的主要目标。
此外,NAC已被证明可以针对与 COVID-19 相关的各种症状及其合并症(包括心血管疾病)发挥保护机制70。鉴于心脏损伤和血栓形成已被确定为 COVID-19 的潜在致命并发症,值得注意的是,静注NAC已被证明可以增强硝酸甘油的血管扩张、抗炎和抗凝血作用,并且这种有用的相互作用已被转化为改善预后,如急性心肌梗死、不稳定型心绞痛和急性肺水肿71,72。NAC管理已被纳入可能的策略中,旨在保护内皮功能和限制严重形式的COVID-19中的微血栓形成73。
对于具有肺部和/或全身症状的严重COVID-19形式,在首次出现胸部症状时给予扑热息痛中毒时常用的高剂量静脉内给药NAC,预计将与抗病毒药物或其他药物一起发挥辅助治疗作用。基于系统的文献搜索,假设了NAC和铜与针对SARS-CoV-2的候选抗病毒疗法(例如瑞德西韦)联合使用的潜在作用74。显然,这种硫醇的潜在抗 COVID-19 机制和特性必须在对照临床试验中得到证实,其中一些试验正在进行中75,76。
Reference:
1. Jamwal S et al. An updated insight into the molecular pathogenesis, secondary complications and potential therapeutics of COVID-19 pandemic. Life Sci. 2020 Sept;257:118105.
2. Huang C et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506.
3. Huang KJ et al. An interferon-γ-related cytokine storm in SARS patients. J Med Virol. 2005;75:185–194.
4. Stegelmeier AA et al. Myeloid Cells during Viral Infections and Inflammation. Viruses. 2019;11(2):168.
5. Schulte-Schrepping J et al. Severe COVID-19 Is Marked by a Dysregulated Myeloid Cell Compartment. Cell. 2020;182(6):1419–1440.
6. Janoff A. Elastase in tissue injury. Ann Rev Med. 1985;36:207–216.
7. Thierry AR. Anti-protease Treatments Targeting Plasmin(ogen) and Neutrophil Elastase May Be Beneficial in Fighting COVID-19. Physiol Rev. 2020;100(4):1597–1598.
8. Cruz DB et al. DNA-bound elastase of neutrophil extracellular traps degrades plasminogen, reduces plasmin formation, and decreases fibrinolysis: proof of concept in septic shock plasma. FASEB J 2019 Dec;33(12):14270-14280.
9. Leonard-Lorant I et al. Acute Pulmonary Embolism in Patients with COVID-19 at CT Angiography and Relationship to d-Dimer Levels. Radiology. 2020;296(3):E189–E191.
10. Wang L et al. Risk assessment of venous thromboembolism and bleeding in COVID-19 patients. Clin Respir J. 2022 Mar;16(3):182-189.
11. Mukaida N et al. Inhibition of neutrophil-mediated acute inflammatory injury by an antibody against interleukin-8 (IL-8). Inflammation Res. 1998;47:151–157.
12. Bao Z et al. Humanized monoclonal antibody against the chemokine CXCL-8 (IL-8) effectively prevents acute lung injury. Int Immunopharmacol. 2010;10(2):259–263
13. Wayne SJ et al. Cell-Mediated Immunity as a Predictor of Morbidity and Mortality in Subjects Over 60. J Gerontol. 1990;45(2):45–48.
14. Ohrui T. Interventions to prevent pneumonia in older adults. Geriatr Gerontol Int. 2004;4(s1):92–95.
15. Saule P et al. Accumulation of memory T cells from childhood to old age, Central and effector memory cells in CD4+ versus effector memory and terminally differentiated memory cells in CD8+ compartment. Mech Ageing Dev. 2006;127(3):274–281.
16. Li H et al. Age-dependent risks of Incidence and Mortality of COVID-19 in Hubei Province and Other Parts of China. Front Med (Lausanne). 2020 Apr 30;7:190.
17. Zhang B et al. Immune phenotyping based on neutrophil-to-lymphocyte ratio and IgG predicts disease severity and outcome for patients with COVID-19. Front Mol Biosci. 2020; 7: 157.
18. Li X et al. Predictive values of neutrophil-to-lymphocyte ratio on disease severity and mortality in COVID-19 patients: a systematic review and meta-analysis Crit Care. 2020 Nov 16;24(1):647.
19. M. Hoffmann et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell 2020 Apr 16;181(2):271-280.e8
20. Gupta A et al. Extrapulmonary manifestations of COVID-19 Nat Med, 26 (2020), pp. 1017-1032,
21. Aleksova A et al. COVID-19 and renin-angiotensin system inhibition: role of angiotensin converting enzyme 2 (ACE2) – is there any scientific evidence for controversy? J Intern Med, 2020 OCT,288 pp. 410-421
22. Violi F et al. Nox2 activation in Covid-19 Redox Biol, 2020 Sep 36:101655.
23. Ragab D et al. The COVID-19 cytokine storm; what we know so far Front Immunol, 11 (2020), p. 1446,
24. Murdaca G et al. The potential role of cytokine storm pathway in the clinical course of viral respiratory pandemic Biomedicines. 2021 Nov 15;9(11):1688.
25. De Flora S et al. Attenuation of influenza-like symptomatology and improvement of cell-mediated immunity with long-term N-acetylcysteine treatment. Eur Respiratory J. 1997 Jul;10(7):1535–1541.
26. Poppe M et al. The NF-κB-dependent and -independent transcriptome and chromatin landscapes of human coronavirus 229E-infected cells. PLoS Pathog. 2017;13(3):e1006286.
27. Geiler J et al. N-acetyl-L-cysteine (NAC) inhibits virus replication and expression of pro-inflammatory molecules in A549 cells infected with highly pathogenic H5N1 influenza A virus. Biochem Pharmacol. 2010;79(3):413–420.
28. Ho W et al. Glutathione and N-Acetylcysteine suppression of human immunodeficiency virus replication in human Monocyte/Macrophages in vitro. AIDS Res Hum Retroviruses. 1992;8(7):1249–1253.
29. Mata M et al. Respiratory syncytial virus inhibits ciliagenesis in differentiated normal human bronchial epithelial cells: effectiveness of N-Acetylcysteine. PLoS One. 2012;7(10):e48037.
30. Scialo F et al. ACE2: the major cell entry receptor for SARS-CoV-2 Lung 2020 Dec;198(6):867-877.
31. Babajani F et al. COVID-19 and renin angiotensin aldosterone system: pathogenesis and therapy. Heal Sci Rep, 2021 Nov 17;4(4):e440.
32. De Flora S et al. Rationale for the use of N-acetylcysteine in both prevention and adjuvant therapy of COVID-19 . FASEB J 2020 Oct;34(10):13185-13193.
33. Veenith T et al. High generation of reactive oxygen species from neutrophils in patients with severe COVID-19 Nature Sci report 2022 Jun,No.10484
34. Suhail S et al. Role of oxidative stress on SARS-CoV (SARS) and SARS-CoV-2 (COVID-19) infection: a review Protein J, 39 (2020), pp. 644-656,
35. Sadowskaa AM et al. Effect of N-acetylcysteine on neutrophil activation markers in healthy volunteers: in vivo and in vitro study. Pharmacol Res. 2006 Mar;53(3):216–225.
36. Kharazmi A et al. N-acetylcysteine inhibits human neutrophil and monocyte chemotaxis and oxidative metabolism. Int J Lmmunopharmac. 1988;10(1):39–46.
37. Allegra L et al. Human Neutrophil Oxidative Bursts and their in vitro Modulation by Different N-Acetylcysteine Concentrations. Drug Res. 2002;52(9):669–676.
38. Tavakolpour S et al. Lymphopenia during the COVID-19 infection: what it shows and what can be learned. Immunol Lett. 2020;225:31–32.
39. Chiba T et al. Fas-mediated apoptosis is modulated by intracellular glutathione in human T cells. Eur J Immunol. 1996;26(5):1164–1169.
40. Lai Z et al. N-acetylcysteine reduces disease activity by blocking mammalian target of rapamycin in T cells from systemic lupus erythematosus patients: A randomized, double-blind, placebo-controlled trial. Arthritis Rheumatology. 2012;64(9):2937–2946.
41. Di Marco F et al. Where are we with the use of N-acetylcysteine as a preventive and adjuvant treatment for COVID-19? Eur Rev Med Pharmacol Sci, 2022 Jan;26(2):715-721.
42.Sharafkhah M et al. Safety and efficacy of N-acetylcysteine for prophylaxis of ventilator-associated pneumonia: a randomized, double blind, placebo-controlled clinical trial. Med Gas Res. 2018 Apr;8(1):19–23.
43. Zhang Q et al. N-acetylcysteine improves oxidative stress and inflammatory response in patients with community acquired pneumonia A randomized controlled trial. Medicine. 2018 Nov;97:e13087.
44. Ragab D et al. The COVID-19 cytokine storm; What we know so far. Front Immunol. 2020;11
45. Hassett P et al. Overexpression of pulmonary extracellular superoxide dismutase attenuates endotoxin induced acute lung injury. Intensive Care Med. 2011 Oct;37:1680–1687.
46. Fox RB. Prevention of granulocyte-mediated oxidant lung injury in rats by a hydroxyl radical scavenger, dimethylthiourea. J Clin Invest. 1984 Oct;74(4):1456–1464.
47. Li L et al. Acute lung injury in patients with COVID-19 infection. Clin Transl Med. 2020 Jan-Dec; 10(1): 20–27.
48. Aruoma OI et al. The antioxidant action of N-acetylcysteine: its reaction with hydrogen peroxide, hydroxyl radical, superoxide, and hypochlorous acid. Free Radic Biol Med. 1989;6(6):593–597.
49. Suter PM et al. N-Acetylcysteine enhances recovery from acute lung injury in man: a randomized, double-blind, placebo-controlled clinical study. Chest. 1994 Jan;105(1):190–4.
50. Spapen H et al. Does N-acetyl-L-cysteine influence cytokine response during early human septic shock? Chest 1998 Jun, 113 (6):1616-24
51. Lai K et al. High-Dose N-Acetylcysteine Therapy for Novel H1N1 Influenza Pneumonia. Ann Intern Med. 2010 May;152(10):687-8.
52. Moradi M et al. The role of glutathione-S-transferase polymorphisms on clinical outcome of ALI/ARDS patient treated with N-acetylcysteine. Respir Med. 2009 Mar;103(3):434–441.
53. Lu X et al. N-acetylcysteine for adults with acute respiratory distress syndrome: a meta-analysis of randomized controlled trials Hong Kong J Emerg Med, 2019 Jan V.26
54. Lewis SR et al. Pharmacological agents for adults with acute respiratory distress syndrome Cochrane Database Syst Rev 2019 Jul 23;7(7):CD004477.
55. Ibrahim H et al. Therapeutic blockade of inflammation in severe COVID-19 infection with intravenous N-acetylcysteine Clin Immunol. 2020 Oct;219:108544.
56/45. Liu Y et al. Experience of N-acetylcysteine airway management in the successful treatment of one case of critical condition with COVID-19. Medicine (Baltimore). 2020 Oct; 99(42): e22577.
57/46. Nasia A et al. Reactive oxygen species as an initiator of toxic innate immune responses in retort to SARS-CoV-2 in an ageing population, consider N-acetylcysteine as early therapeutic intervention. Toxicol Rep. 2020 Jun 18;7:768-771.
58. Gaynitdinova V.V. et al. N-acetylcysteine as a part of complex treatment of moderate COVID-associated pneumonia Pulmonologiya, 2021 V.31, No.1. pp. 21-29,
59. Assimakopoulos SF et al. N-acetyl-cysteine reduces the risk for mechanical ventilation and mortality in patients with COVID-19 pneumonia: a two-center retrospective cohort study Infect Dis (Lond). 2021 Nov;53(11):847-854.
60. S. Frades et al. The role of intermediate respiratory care units in preventing ICU collapse during the COVID pandemic. Int J Respir Pulm Med, 7 (2020), p. 147,
61. Avdeev SN et al. N-acetylcysteine for the treatment of COVID-19 among hospitalized patients J Infect, 2022 Jan;84(1):94-118.
62. Ahluwalia B et al. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad SCAND J GASTROENTERO. 2017 v.52 pp.1185-1193
63. Green JL et al. Oral and Intravenous Acetylcysteine for Treatment of Acetaminophen Toxicity: A Systematic Review and Meta-analysis. West J Emerg Med. 2013 May;14(3):218–226.
64. Dósa E et al. Dose escalation study of intravenous and intra-arterial N-acetylcysteine for the prevention of oto- and nephrotoxicity of cisplatin with a contrast-induced nephropathy model in patients with renal insufficiency. Fluids and Barriers of the CNS. 2017 Oct;14(1):26.
65. Hong SY et al. Effect of High-Dose Intravenous N-acetylcysteine on the Concentration of Plasma Sulfur-Containing Amino Acids. Korean J Intern Med. 2005 Sept;20:217–223
66. Grein J et al. Compassionate Use of Remdesivir for Patients with Severe Covid-19. NEJM. 2020 Jun; 382(24):2327–2336.
67. Yazdi AP et al. Clinical Trial Assessment of Intermittent and Continuous Infusion Dose of N-Acetylcysteine on Redox Status of the Body in Patients with Sepsis Admitted to the ICU. J Intensive Care Med. 2020 Dec;35(12):1383-1388.
68. Molnar Z et al. N-Acetylcysteine treatment to prevent the progression of multisystem organ failure: a prospective, randomized, placebo-controlled study. Crit Care Med. 1999 Jun;27(6):1100–1104.
69. Bauer SR et al. What is the role of supplementation with ascorbic acid, zinc, vitamin D, or N‐acetylcysteine for prevention or treatment of COVID‐19? Cleve Clin J Med. 2020 Jun. Online ahead of print.
70. Šalamon Š et al. Medical and dietary uses of N‐acetylcysteine. Antioxidants (Basel). 2019 Apr 28;8(5):111.
71. Marchetti G et al. Use of N‐acetylcysteine in the management of coronary artery diseases. Cardiologia. 1999 Jul;44(7):633‐7.
72. Pasupathy S et al. Early use of N‐acetylcysteine with nitrate therapy in patients undergoing primary percutaneous coronary intervention for ST‐segment‐elevation myocardial infarction reduces myocardial infarct size (the NACIAM Trial [N‐acetylcysteine in Acute Myocardial Infarction]). Circulation. 2017 Sep 5;136(10):894-903.
73. Guglielmetti G et al. “War to the knife” against thromboinflammation to protect endothelial function of COVID‐19 patients. Crit Care. 2020;24:365. Published 2020 Jun 19. 10.
74. Andreou A et al. COVID‐19: the potential role of copper and N‐acetylcysteine (NAC) in a combination of candidate antiviral treatments against SARS‐CoV‐2. In Vivo. 2020 Jun;34(3 Suppl):1567-1588.
75.Jorge‐Aarón RM et al. N‐acetylcysteine as a potential treatment for novel coronavirus disease 2019
Future Microbiol. 2020 Jun : 10.2217/fmb-2020-0074.
76. Poe FL et al. N‐Acetylcysteine: a potential therapeutic agent for SARS‐CoV‐2. Med Hypotheses. 2020 Oct;143:109862.

